元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
上述科学家的研究按照时间先后排序合理的是__________ (填数字序号)。
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
(1)门捷列夫将已有元素按照相对原子质量排序,同一__________ (填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是__________ ,第5列方框中“Te=128?”的问号表达的含义是__________ 。
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是__________ (填字母序号)。
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为__________ ,元素Z的离子结构示意图为__________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__________ 。
(3)元素W位于周期表的第__________ 族,其非金属性比元素R弱,用原子结构的知识解释原因____________________ 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式____________________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________________ 。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
| Ni=Co=59 | |||||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | I=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Pb=207 |
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
更新时间:2017-08-31 17:26:17
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
【推荐1】短周期元素A、B、C、D、E、F、G、H、I、J在周期表中的位置如下:

按要求回答下列问题。
(1)上表元素中,形成气态氢化物最稳定的是_______ 元素(填元素符号)。
(2)32Ge与B同族,32Ge的最高价的氧化物与氢氧化钠反应的化学方程式为
_______ 。
(3)等电子的D、F、G、H四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)
________________________________
(4)D、I元素形成的氢化物中,沸点较高的是_______ ,理由_______ 。
(5)34Se非金属性比D_______ (填“强”或“弱”),从原子结构的角度解释其原因为_______ 。
(6)用电子式表示E、G形成化合物的过程_______ 。

按要求回答下列问题。
(1)上表元素中,形成气态氢化物最稳定的是
(2)32Ge与B同族,32Ge的最高价的氧化物与氢氧化钠反应的化学方程式为
(3)等电子的D、F、G、H四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)
(4)D、I元素形成的氢化物中,沸点较高的是
(5)34Se非金属性比D
(6)用电子式表示E、G形成化合物的过程
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】下表中的实线表示元素周期表的部分边界,a-j分别表示周期表中对应位置的元素。回答下列问题:
(1)请在上表中用实线补全元素周期表边界_______ 。
(2)元素b在元素周期表中的位置是_______ ;元素a与d形成的4核18电子物质的分子式_______ 。
(3)元素e、g、h的简单离子半径由小到大的顺序为______ 。(用离子符号表示)
(4)元素e的气态氢化物比元素i的气态氢化物稳定性______ 。(填“强”或“弱”)。
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为______ 。
(6)用电子式表示元素i、j形成化合物的过程______________________ 。
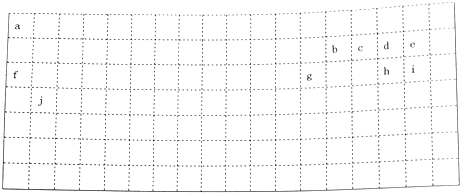
(1)请在上表中用实线补全元素周期表边界
(2)元素b在元素周期表中的位置是
(3)元素e、g、h的简单离子半径由小到大的顺序为
(4)元素e的气态氢化物比元素i的气态氢化物稳定性
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为
(6)用电子式表示元素i、j形成化合物的过程
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。
(1)元素周期表的非金属元素中,属于主族元素的共有________ 种。
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________ 。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X 射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。
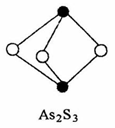
其分子中S原子的杂化方式为________ 。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______ 。
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性: BrCH2COOH >CH3COOH。据此推测,pKa:ClCH2COOH______ FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式:________ (若存在配位键,请用箭头标出)。
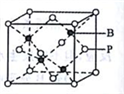
(5)磷化硼的晶胞模型如右图所示,晶胞参数为a pm,已知B、P的原子半径分别表示为rBpm、rP pm。该晶胞中磷原子的配位数为________ ,晶体中原子的空间利用率为______ 。
(1)元素周期表的非金属元素中,属于主族元素的共有
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X 射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。

其分子中S原子的杂化方式为
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性: BrCH2COOH >CH3COOH。据此推测,pKa:ClCH2COOH
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式:
(5)磷化硼的晶胞模型如右图所示,晶胞参数为a pm,已知B、P的原子半径分别表示为rBpm、rP pm。该晶胞中磷原子的配位数为

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐1】如表为元素周期表的一部分,用化学用语回答下列问题:
(1)⑧的原子结构示意图为________ 。
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是________ (填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________ (填化学式)。
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为________ 。②④两种元素形成的原子数目比为1:2的共价化合物的结构式为________ 。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为________ 。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
真题
解题方法
【推荐2】 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第_______ 周期,第_______ 族。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是_______ 。
(4)已知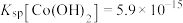 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为_______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有_______ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: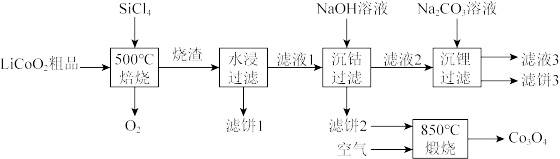
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
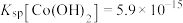 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】镓(Ga)是非常重要的稀土金属,其化合物广泛应用于诸多领域。
(1)镓元素在元素周期表中的位置是___________ 。
(2)GaN作为第三代半导体材料,广泛应用于大功率充电器和5G通讯技术。工业上利用炼锌矿渣[主要含可溶性铁酸镓 、铁酸锌
、铁酸锌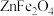 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下:
①“酸浸”过程中 发生的反应的离子方程式为
发生的反应的离子方程式为___________ 。
②利用上述工艺,酸浸后的酸浸液应加入___________ 固体充分反应后再进行萃取。
③“反萃取”后,溶液中镓元素的存在形式为___________ (填离子符号)。
④回收金属元素时,锌主要从___________ 中回收。
A.浸出渣 B.酸浸液 C.水相 D.有机相
(3)MOCVD法是通过 与
与 反应得到GaN和另一种产物,该反应的化学方程式为
反应得到GaN和另一种产物,该反应的化学方程式为___________ 。
(4)该流程中,可以循环使用的物质是___________ 。
(1)镓元素在元素周期表中的位置是
(2)GaN作为第三代半导体材料,广泛应用于大功率充电器和5G通讯技术。工业上利用炼锌矿渣[主要含可溶性铁酸镓
 、铁酸锌
、铁酸锌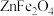 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下: 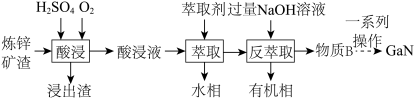
| 金属离子 |  |  |  |  |
| 萃取率/% | 0 | 0 | 99 | 97~98.5 |
 发生的反应的离子方程式为
发生的反应的离子方程式为②利用上述工艺,酸浸后的酸浸液应加入
③“反萃取”后,溶液中镓元素的存在形式为
④回收金属元素时,锌主要从
A.浸出渣 B.酸浸液 C.水相 D.有机相
(3)MOCVD法是通过
 与
与 反应得到GaN和另一种产物,该反应的化学方程式为
反应得到GaN和另一种产物,该反应的化学方程式为(4)该流程中,可以循环使用的物质是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】下图是部分短周期元素的常见化合价与原子序数的关系图:
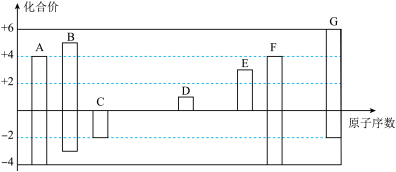
(1)元素A在周期表中的位置___________ 。
(2)用电子式表示D2G的形成过程___________ ,其所含化学键类型为___________ 。
(3)C2-、D+、G2-离子半径由大到小顺序是___________ (用离子符号回答)。
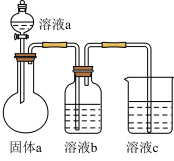
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为___________ ,___________ 。
②溶液c中的离子方程式为___________ 。
③请从原子结构的角度解释非金属性B>A的原因___________ 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为___________ 。
②用一个离子方程式表示该反应___________ 。

(1)元素A在周期表中的位置
(2)用电子式表示D2G的形成过程
(3)C2-、D+、G2-离子半径由大到小顺序是
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为
②溶液c中的离子方程式为
③请从原子结构的角度解释非金属性B>A的原因

(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为
②用一个离子方程式表示该反应
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语 回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为______ 。③、④、⑤、⑥简单离子半径由小到大的顺序为______ 。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______ 。
(4)由表中两种元素的原子按1:1组成的常见液态化合物易被催化分解,可使用的催化剂为__________ 。
a.MnO2 b.FeCl3 c.CuSO4 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
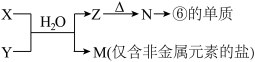
a) X溶液与Y溶液反应的离子方程式为_________ ,
b) N→⑥的单质的化学方程式为________________ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1:1组成的常见液态化合物易被催化分解,可使用的催化剂为
a.MnO2 b.FeCl3 c.CuSO4 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

a) X溶液与Y溶液反应的离子方程式为
b) N→⑥的单质的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】(1)氨易溶于水的原因是_______ ;_______ (写出两点即可)。
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越_______ (填“强”或“弱”)。以下各种含氧酸①H3RO4、②(HO)RO3、③H4RO4、④(HO)2RO2的酸性由强到弱的顺序排列为_______ (填序号)。
(3)为了减缓温室效应,科学家设计反应CO2+4H2=CH4+2H2O以减少空气中CO2的排放量。若有1 mol CH4生成,则有_______ mol σ键和_______ mol π键断裂。
(4)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素
)、尿素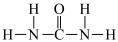 等
等
①尿素分子中四种元素的电负性由大到小顺序是_______ 。
②NH 中H-N-H键角比NH3中H-N-H键角大,原因为
中H-N-H键角比NH3中H-N-H键角大,原因为_______ 。
(5)①与H2O分子互为等电子体的阴离子为_______
②[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_______ 。
(6)根据对角线规则,铍(Be)与铝性质相似。对铍及其化合物的推断肯定不正确的是_______
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
(3)为了减缓温室效应,科学家设计反应CO2+4H2=CH4+2H2O以减少空气中CO2的排放量。若有1 mol CH4生成,则有
(4)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素
)、尿素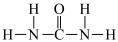 等
等①尿素分子中四种元素的电负性由大到小顺序是
②NH
 中H-N-H键角比NH3中H-N-H键角大,原因为
中H-N-H键角比NH3中H-N-H键角大,原因为(5)①与H2O分子互为等电子体的阴离子为
②[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)根据对角线规则,铍(Be)与铝性质相似。对铍及其化合物的推断肯定不正确的是
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
您最近一年使用:0次



