碳酸钠的结晶水合物在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体( Na 2CO3·nH2O )。为测定其组成,某同学在不同温度下加热样品(温度逐渐升高),实验结果记录如 下:
(1)该实验称量用的仪器是_______ ;实验记录中的容器是指_______ (填仪器名字);冷却必须放在_______ 中进行(填仪器名称)。
(2)该学生停止实验的依据是_______ 。
(3)该样品中 n 的值为_______ 。(保留一位小数)
(4)若该实验过程中出现下列操作,其中可能会使实验结果 n的值偏大的是(_______ )
A.容器内壁原来附着有受热不分解的物质
B.碳酸钠晶体样品已有少量风化
C.加热后容器在空气中冷却
D.加热过程中有少量晶体溅出
(5)如果碳酸钠晶体样品不纯,测定结果(_______ )
A.没有偏差 B.一定偏小 C.一定偏大 D.无法确定
实验次序 | 加热温度 | 容器+试样质量(g) |
常温 | 62.212 | |
1 | T1 | 56.886 |
2 | T2 | 49.654 |
3 | T3 | 45.633 |
4 | T4 | 45.633 |
容器的质量为33.600 g | ||
(2)该学生停止实验的依据是
(3)该样品中 n 的值为
(4)若该实验过程中出现下列操作,其中可能会使实验结果 n的值偏大的是(
A.容器内壁原来附着有受热不分解的物质
B.碳酸钠晶体样品已有少量风化
C.加热后容器在空气中冷却
D.加热过程中有少量晶体溅出
(5)如果碳酸钠晶体样品不纯,测定结果(
A.没有偏差 B.一定偏小 C.一定偏大 D.无法确定
更新时间:2017-12-29 18:19:56
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】亚硝酰氯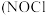 ,熔点:
,熔点: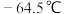 ,沸点:
,沸点: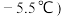 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸 :
:
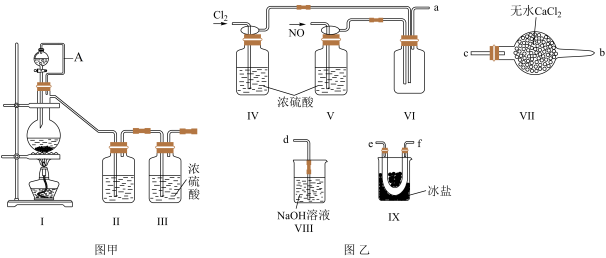
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
(2)将制得的NO和 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
 装置连接顺序为
装置连接顺序为
________  按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示 。
。
 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。
 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、 通入装置Ⅴ中,你同意此观点吗?
通入装置Ⅴ中,你同意此观点吗?_______  填“同意”或“不同意”
填“同意”或“不同意” ,原因是
,原因是___________ 。
 实验开始的时候,先通入氯气,再通入NO,原因为
实验开始的时候,先通入氯气,再通入NO,原因为________________________ 。
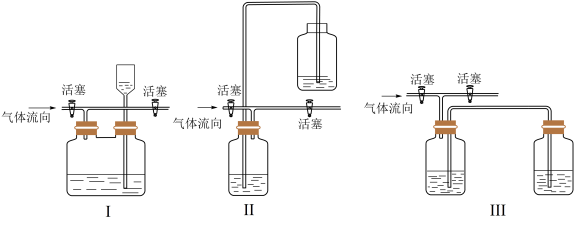
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置______ ;
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________ 。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________ 。
(6)制得的NOCl中可能含有少量 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取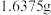 样品溶于
样品溶于 溶液中,加入几滴
溶液中,加入几滴 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的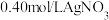 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗 溶液
溶液 。则该样品的纯度为
。则该样品的纯度为__________ 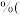 保留1位小数
保留1位小数
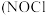 ,熔点:
,熔点: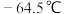 ,沸点:
,沸点: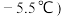 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸 :
: 
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净 |  | 浓盐酸 |  |
| 制备纯净NO | Cu | 稀硝酸 |  |
(2)将制得的NO和
 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。 装置连接顺序为
装置连接顺序为
 按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示 。
。 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、 通入装置Ⅴ中,你同意此观点吗?
通入装置Ⅴ中,你同意此观点吗? 填“同意”或“不同意”
填“同意”或“不同意” ,原因是
,原因是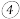 实验开始的时候,先通入氯气,再通入NO,原因为
实验开始的时候,先通入氯气,再通入NO,原因为(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置

(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:
(6)制得的NOCl中可能含有少量
 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取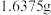 样品溶于
样品溶于 溶液中,加入几滴
溶液中,加入几滴 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的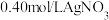 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗 溶液
溶液 。则该样品的纯度为
。则该样品的纯度为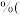 保留1位小数
保留1位小数
您最近一年使用:0次
【推荐2】钕铁硼磁铁因其超强的磁性被誉为“永磁之王”。一种从钕铁硼废料[含钕(Nd,质量分数为28.8%)、Fe、B]中提取氧化钕的工艺流程如图所示:

已知:Nd稳定的化合价为+3价;金属钕的活动性较强,能与酸发生置换反应;Nd(H2PO4)3难溶于水;硼不与稀硫酸反应。
(1)可以选择_______(填标号)除去钕铁硼废料表面的矿物油污。
(2)“粉碎”的目的是 _______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)常温下,“沉钕”过程中,Nd(H2PO4)3沉淀完全时的pH为2.3,溶液中的c(Fe2+)=2.0 mol·L-1,此时_______ (填“有”或“无”)Fe(OH)2沉淀生成。列式计算说明原因_______ (常温下,Ksp[Fe(OH)2]=8.0 ×10-16)。
(5)“碱转换”时,得到Nd(OH)3沉淀,“滤液2”的主要溶质为_______ 。
(6)焙烧沉淀[Nd2(C2O4)3·10H2O]时, 生成无毒的气体,该反应的化学方程式为_______ 。
(7)若用100g钕铁硼废料进行实验,最终得到30.24 g Nd2O3,则Nd2O3的回收率为_______ 。

已知:Nd稳定的化合价为+3价;金属钕的活动性较强,能与酸发生置换反应;Nd(H2PO4)3难溶于水;硼不与稀硫酸反应。
(1)可以选择_______(填标号)除去钕铁硼废料表面的矿物油污。
| A.酒精清洗 | B.NaOH溶液浸泡 | C.纯碱溶液浸泡 | D.稀硫酸 |
(3)“滤渣1”的主要成分为
(4)常温下,“沉钕”过程中,Nd(H2PO4)3沉淀完全时的pH为2.3,溶液中的c(Fe2+)=2.0 mol·L-1,此时
(5)“碱转换”时,得到Nd(OH)3沉淀,“滤液2”的主要溶质为
(6)焙烧沉淀[Nd2(C2O4)3·10H2O]时, 生成无毒的气体,该反应的化学方程式为
(7)若用100g钕铁硼废料进行实验,最终得到30.24 g Nd2O3,则Nd2O3的回收率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氰化钠(NaCN)是一种重要的基本化工原料。工业上常以戊烷(C5H12)和液氨为原料制备,主要工艺流程如图:

已知:
①NaCN易溶于水,溶解度随温度升高而增大;
②NaCN溶液受热时易发生水解反应:NaCN+2H2O HCOONa+NH3↑;
HCOONa+NH3↑;
③NaCN在空气中加热易被氧化。
回答下列问题:
(1)写出NaCN的电子式:___ 。
(2)流程中“雾化”的目的是___ 。
(3)写出“高温裂解”时反应的化学方程式:___ 。
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗派、干燥,其中蒸发时,温度宜控制在60℃以下,原因是___ 。
(5)“滤液”中的主要溶质是___ 。
(6)某学习小组的同学欲测定某企业排放废水中氰化钠的含量.实验如下:取200.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol•L-1的标准AgNO3溶液滴定.消耗AgNO3溶液的体积为1.50mL。(已知Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应)
①滴定终点的现象是___ 。
②废水中氰化钠的浓度为___ mg•L-1。

已知:
①NaCN易溶于水,溶解度随温度升高而增大;
②NaCN溶液受热时易发生水解反应:NaCN+2H2O
 HCOONa+NH3↑;
HCOONa+NH3↑;③NaCN在空气中加热易被氧化。
回答下列问题:
(1)写出NaCN的电子式:
(2)流程中“雾化”的目的是
(3)写出“高温裂解”时反应的化学方程式:
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗派、干燥,其中蒸发时,温度宜控制在60℃以下,原因是
(5)“滤液”中的主要溶质是
(6)某学习小组的同学欲测定某企业排放废水中氰化钠的含量.实验如下:取200.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol•L-1的标准AgNO3溶液滴定.消耗AgNO3溶液的体积为1.50mL。(已知Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应)
①滴定终点的现象是
②废水中氰化钠的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】过氧化钠保存不当容易变质。
(1)某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液,证明过氧化钠已经变质_______________________________________________________________ 。
(2)检验样品中还有过氧化钠的方法是___________________________________ 。
(3)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设
计用下图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和B中发生反应的离子方程式:
装置A:__________________________ ,装置B:___________________________ 。
②NaOH的作用是_______________ 。
③本实验中测量气体体积时应注意的事项有__________________________________________________________________________________________________________ 。
④他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品
中过氧化钠的质量分数为____________ 。
(1)某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液,证明过氧化钠已经变质
(2)检验样品中还有过氧化钠的方法是
(3)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设
计用下图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和B中发生反应的离子方程式:
装置A:
②NaOH的作用是
③本实验中测量气体体积时应注意的事项有
④他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品
中过氧化钠的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】NOCl(名称为亚硝酰氯,熔点为-64.5℃,沸点为-5.5℃)是有机物合成中的重要试剂,为红褐色液体或黄色气体,遇水发生反应:2NOCl+H2O=NO+NO2+2HCl。某学习小组在实验室用Cl2和NO按如图装置制备NOCl,并测定其纯度。请回答下列问题:

(1)仪器a的名称是______ ;a中反应的离子方程式为_______ 。
(2)试剂Y为______ ;如果G中浓盐酸液体不能顺利流下,可采取的措施______ 。
(3)从三颈烧瓶逸出的尾气先通入浓硫酸再通入NaOH溶液吸收,须要先通入浓硫酸原因是______ 。
(4)NOCl与NaOH溶液反应的化学方程式为______ 。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(5)测量产物NOCl纯度:取三颈烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL,产物中NOCl纯度的计算式为______ 。

(1)仪器a的名称是
(2)试剂Y为
(3)从三颈烧瓶逸出的尾气先通入浓硫酸再通入NaOH溶液吸收,须要先通入浓硫酸原因是
(4)NOCl与NaOH溶液反应的化学方程式为
(5)测量产物NOCl纯度:取三颈烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL,产物中NOCl纯度的计算式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】国家标准规定葡萄酒中SO2的最大使用量为0.25g/L。某兴趣小组用如图1所示装置(夹持装置已略去)收集某葡萄酒中的SO2,并对其含量进行测定。

(1)仪器B的名称为___________ ,仪器A的作用是___________ 。
(2)向B中加入300.00mL葡萄酒和适量稀硫酸,加热使SO2全部逸出,并与C中 完全反应,C中发生反应的离子方程式为
完全反应,C中发生反应的离子方程式为___________ 。
(3)除去C中剩余的 ,然后用0.0900mol/L的NaOH标准溶液进行滴定,NaOH标准溶液应盛装在图2中的
,然后用0.0900mol/L的NaOH标准溶液进行滴定,NaOH标准溶液应盛装在图2中的___________ (填“①”或“②”)中,理由是___________ 。
(4)滴定前,先在锥形瓶中滴入几滴无色酚酞。滴定过程中,眼睛应注意___________ 的变化,达到滴定终点的标志是___________ 。
(5)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为___________ g/L。

(1)仪器B的名称为
(2)向B中加入300.00mL葡萄酒和适量稀硫酸,加热使SO2全部逸出,并与C中
 完全反应,C中发生反应的离子方程式为
完全反应,C中发生反应的离子方程式为(3)除去C中剩余的
 ,然后用0.0900mol/L的NaOH标准溶液进行滴定,NaOH标准溶液应盛装在图2中的
,然后用0.0900mol/L的NaOH标准溶液进行滴定,NaOH标准溶液应盛装在图2中的(4)滴定前,先在锥形瓶中滴入几滴无色酚酞。滴定过程中,眼睛应注意
(5)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
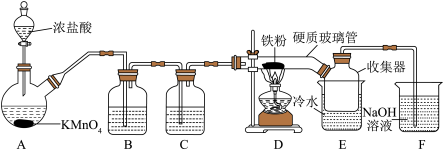
【推荐1】FeCl3在工农业生产中有广泛的应用,某实验小组用如下装置模拟干法制备FeCl3。已知:FeCl3加热易升华,在空气中易潮解。
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ ;该反应体现了浓盐酸的性质是_______ 。
(2)装置C的作用是_______ ;硬质玻璃管直接接入收集器而不用导管连接D和E的原因是_______ 。
(3)上述装置存在一处缺陷,会导致产品FeCl3不纯,改进的方法是_______ 。
(4)装置F中发生反应的离子方程式为_______ 。
(5)称取收集器中粗产品m g配制成100 mL溶液,进行FeCl3纯度的测定(粗产品中的杂质不参与反应,已知: )。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为
)。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为_______ 。

回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)装置C的作用是
(3)上述装置存在一处缺陷,会导致产品FeCl3不纯,改进的方法是
(4)装置F中发生反应的离子方程式为
(5)称取收集器中粗产品m g配制成100 mL溶液,进行FeCl3纯度的测定(粗产品中的杂质不参与反应,已知:
 )。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为
)。取10 mL溶液置于锥形瓶中,加入过量的KI溶液充分反应生成I2,生成的I2恰好与V mLc mol/LNa2S2O3溶液反应。则FeCl3的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】 是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的
是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的 气体易爆炸。
气体易爆炸。 与纯净的
与纯净的 反应可制得
反应可制得 和NaCl。实验室用
和NaCl。实验室用 制备和收集一定量的
制备和收集一定量的 的装置如图 (部分夹持装置略),其中装置F为
的装置如图 (部分夹持装置略),其中装置F为 的收集装置。
的收集装置。

(1)装置A中,仪器X的名称是___________ ,其发生反应的离子方程式是___________ 。
(2)装置B中所盛试剂为___________ 。
(3)装置E中所盛试剂是 ,其作用为
,其作用为___________ 。
(4)葡萄糖( )、氯酸钾和适量的
)、氯酸钾和适量的 溶液反应可以得到
溶液反应可以得到 ,反应中生成的
,反应中生成的 所起作用是
所起作用是___________ ,其化学方程式为___________ 。
(5)实验中制得的 的质量可通过如图所示装置进行测定。过程如下:
的质量可通过如图所示装置进行测定。过程如下:

Ⅰ.在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
Ⅱ.按图组装好仪器:在玻璃液封管中加入水,浸没导管口;
Ⅲ.将生成的 气体由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液;
气体由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液;
Ⅳ.用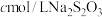 标准液滴定锥形瓶中的液体,共用去
标准液滴定锥形瓶中的液体,共用去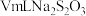 溶液(已知:
溶液(已知: )。
)。
①装置中玻璃液封管的作用是___________ 。
②测得通入 的质量
的质量
___________ g(用整理过的含c、V的代数式表示)。
 是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的
是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的 气体易爆炸。
气体易爆炸。 与纯净的
与纯净的 反应可制得
反应可制得 和NaCl。实验室用
和NaCl。实验室用 制备和收集一定量的
制备和收集一定量的 的装置如图 (部分夹持装置略),其中装置F为
的装置如图 (部分夹持装置略),其中装置F为 的收集装置。
的收集装置。
(1)装置A中,仪器X的名称是
(2)装置B中所盛试剂为
(3)装置E中所盛试剂是
 ,其作用为
,其作用为(4)葡萄糖(
 )、氯酸钾和适量的
)、氯酸钾和适量的 溶液反应可以得到
溶液反应可以得到 ,反应中生成的
,反应中生成的 所起作用是
所起作用是(5)实验中制得的
 的质量可通过如图所示装置进行测定。过程如下:
的质量可通过如图所示装置进行测定。过程如下:
Ⅰ.在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
Ⅱ.按图组装好仪器:在玻璃液封管中加入水,浸没导管口;
Ⅲ.将生成的
 气体由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液;
气体由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液;Ⅳ.用
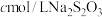 标准液滴定锥形瓶中的液体,共用去
标准液滴定锥形瓶中的液体,共用去 溶液(已知:
溶液(已知: )。
)。①装置中玻璃液封管的作用是
②测得通入
 的质量
的质量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】欲测定金属镁的相对原子质量,请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。
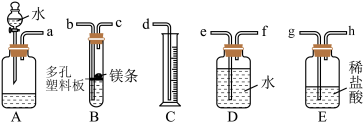
回答下列问题(气流从左到右):
(1)各种仪器连接的先后顺序是___________ (用小写字母表示)。
________接________、_______接______、________接________、________接_______
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是___________ (填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为VamL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为mg,并将其投入试管B中的多孔塑料板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其中的水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水VbmL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为___________ 。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据___________ (填“偏大”“偏小”或“无影响”)。

回答下列问题(气流从左到右):
(1)各种仪器连接的先后顺序是
________接________、_______接______、________接________、________接_______
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为VamL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为mg,并将其投入试管B中的多孔塑料板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其中的水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水VbmL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据
您最近一年使用:0次



