(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________ .
(2)上述(B)操作的目的是___________________________________ 。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________ 。
(4)滴定开始后,眼睛注视_________________________________________________ .直到加入一滴氢氧化钠后,溶液由__________ 变为___________ 时为止.
(5)下列操作中可能使所测盐酸的浓度数值偏低的是________ .
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
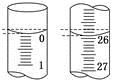
(6)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为________ mL,终点读数为_______________________ mL;所用盐酸溶液的体积为____________ mL.
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
(2)上述(B)操作的目的是
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)
(4)滴定开始后,眼睛注视
(5)下列操作中可能使所测盐酸的浓度数值偏低的是
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(6)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为

更新时间:2018-01-03 14:32:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】滴定法是化学上常用的定量分析的方法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
Ⅰ.甲化学兴趣小组取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.200 0 mol·L-1的标准NaOH溶液进行滴定,重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________ 。(填标号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是_________________ 。
(3)根据表中数据,计算待测盐酸溶液的浓度为________ mol·L-1。
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01 mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,试回答下列问题:
(4)步骤①发生的化学反应方程式为__________ ;加入的指示剂是____________ 。
(5)步骤②应使用________ 式滴定管。
(6)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是________ 。(填标号)
A.配制标准Na2S2O3溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准Na2S2O3溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.滴定前尖嘴部分有气泡,滴定后消失
Ⅰ.甲化学兴趣小组取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.200 0 mol·L-1的标准NaOH溶液进行滴定,重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是
(3)根据表中数据,计算待测盐酸溶液的浓度为
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01 mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,试回答下列问题:
(4)步骤①发生的化学反应方程式为
(5)步骤②应使用
(6)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是
A.配制标准Na2S2O3溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准Na2S2O3溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.滴定前尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】双指示剂滴定法可用于测定烧碱样品(含Na2CO3)的纯度。实验步骤如下:
①迅速称取烧碱样品0.5000g,溶解后配制成100.00mL溶液,备用。
②将0.1000mol·L-1 HCl标准溶液装入酸式滴定管,调零,记录起始读数V0 = 0.00mL;
③用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点 (此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1 = 21.70mL;
④然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2 = 23.70mL。回答下列问题:
(1)将准确称取的烧碱样品配成100.00mL待测液,需要的主要仪器除烧杯、玻璃棒外,还必须用到的玻璃仪器有___________ 、___________ 。
(2)滴定至第一终点的过程中,发生反应的离子方程式为___________ 、___________ 。
(3)判断滴定至第二终点的现象是___________ 。
(4)样品中NaOH的质量分数w(NaOH) =___________ %。(计算结果保留小数点后2位)
(5)下列操作会导致测得的NaOH质量分数偏高的是___________ 。(填序号)
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数V1时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
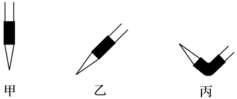
(6)排出碱式滴定管中的气泡应采用操作___________ (填“甲”“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
①迅速称取烧碱样品0.5000g,溶解后配制成100.00mL溶液,备用。
②将0.1000mol·L-1 HCl标准溶液装入酸式滴定管,调零,记录起始读数V0 = 0.00mL;
③用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点 (此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1 = 21.70mL;
④然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2 = 23.70mL。回答下列问题:
(1)将准确称取的烧碱样品配成100.00mL待测液,需要的主要仪器除烧杯、玻璃棒外,还必须用到的玻璃仪器有
(2)滴定至第一终点的过程中,发生反应的离子方程式为
(3)判断滴定至第二终点的现象是
(4)样品中NaOH的质量分数w(NaOH) =
(5)下列操作会导致测得的NaOH质量分数偏高的是

a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数V1时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
(6)排出碱式滴定管中的气泡应采用操作
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】乙二酸(HOOC—COOH)俗名草酸,M(H2C2O4)=90g/mol,是一种有还原性的有机弱酸,在化学上有广泛应用。
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,加入少量硫酸酸化,用0.1000mol·L-1 KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
解答下列问题:
(1)KMnO4标准液装入________ (填“酸式”或“碱式”)滴定管。
(2)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为______________________ ,滴定终点的现象为______________________________________________________ 。
(3)计算此样品的纯度为____________ (保留两位小数)。
(4)误差分析:下列操作会导致测定结果偏高的是______ (填字母)。
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,加入少量硫酸酸化,用0.1000mol·L-1 KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
解答下列问题:
(1)KMnO4标准液装入
(2)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为
(3)计算此样品的纯度为
(4)误差分析:下列操作会导致测定结果偏高的是
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】滴定是一种重要的定量实验方法。现拟用KMnO4溶液去测定市场上售卖的草酸的纯度,步骤如下:(已知:M(H2C2O4)=90 g·mol-1)
①称取1.260 g草酸样品,将其制成100 mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用浓度为0.05000 mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式___________ 。
(2)滴定时盛装KMnO4标准溶液所用仪器为___________ 。
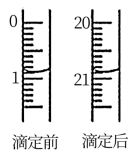
(3)由如图可知消耗KMnO4溶液体积为___________ mL
(4)滴定过程中眼睛应注视___________ ,滴定终点的现象为_____ 。
(5)通过上述数据,求得草酸的纯度为___________ 。
(6)以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果___________ (偏大、偏小或无影响,下同);滴定前有气泡,滴定后气泡消失,引起实验结果___________ ;滴定前正确读数,滴定后俯视,引起实验结果___________ 。
①称取1.260 g草酸样品,将其制成100 mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用浓度为0.05000 mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式
(2)滴定时盛装KMnO4标准溶液所用仪器为
(3)由如图可知消耗KMnO4溶液体积为

(4)滴定过程中眼睛应注视
(5)通过上述数据,求得草酸的纯度为
(6)以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____________________ 。滴定终点的现象是_________________________ 。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___________ (填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
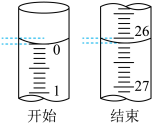
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为_____ mL。
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗.有下列药品:① 固体;②
固体;②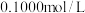 的标准
的标准 溶液;③未知浓度的盐酸;④
溶液;③未知浓度的盐酸;④ 溶液.试回答以下问题:
溶液.试回答以下问题:
(1)做酸碱中和滴定时,还缺少的试剂有蒸馏水、____________ 。
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入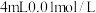 的
的 酸性溶液和
酸性溶液和 (乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间
(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间
_______  (填“>”“=”或“<”)。写出该反应的离子方程式:
(填“>”“=”或“<”)。写出该反应的离子方程式:____________________________________________________ 。
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量硫酸酸化,将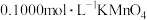 溶液装入
溶液装入______ (填“酸式”或“碱式”)滴定管,进行滴定操作;当____________________ ,说明达到滴定终点。
③计算:重复操作2次,记录实验数据如下.则此样品的纯度为_______ 。(已知 的相对分子质量为90)
的相对分子质量为90)
④误差分析:下列操作会导致测定结果偏高的是_________________ 。
A.未用标准浓度的酸性 溶液润洗滴定管
溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.观察读数时,滴定前仰视,滴定后俯视
 固体;②
固体;②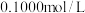 的标准
的标准 溶液;③未知浓度的盐酸;④
溶液;③未知浓度的盐酸;④ 溶液.试回答以下问题:
溶液.试回答以下问题:(1)做酸碱中和滴定时,还缺少的试剂有蒸馏水、
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入
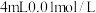 的
的 酸性溶液和
酸性溶液和 (乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间
(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间
 (填“>”“=”或“<”)。写出该反应的离子方程式:
(填“>”“=”或“<”)。写出该反应的离子方程式:(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量硫酸酸化,将
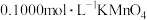 溶液装入
溶液装入③计算:重复操作2次,记录实验数据如下.则此样品的纯度为
 的相对分子质量为90)
的相对分子质量为90)序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.20 |
A.未用标准浓度的酸性
 溶液润洗滴定管
溶液润洗滴定管B.滴定前锥形瓶有少量水
C.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】滴定实验是化学学科中重要的定量实验。 请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是______ (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1000 mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
①滴定时发生的离子反应方程式___________ 。
②KMnO4溶液应装在___________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是___________ 。
③该草酸溶液的物质的量浓度为___________ 。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaCl溶液,可选用的指示剂是___________ (填选项字母)。当Cl-恰好沉淀完全时,此时指示剂也恰好开始显色,请问此时指示剂的物质的量浓度为___________ 。
A.NaSCN B.NaBr C.NaCN D.Na2CrO4
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1000 mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 1.00 | 22.50 |
| 第四次 | 25.00 | 4.00 | 24.10 |
②KMnO4溶液应装在
③该草酸溶液的物质的量浓度为
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaCl溶液,可选用的指示剂是
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.0×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
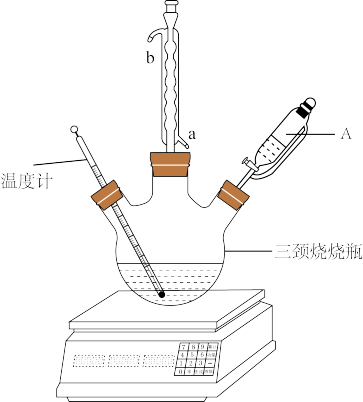
【推荐2】过碳酸钠(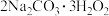 )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下(固定仪器已略去)。
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下(固定仪器已略去)。
已知:主反应: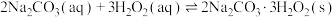

按下列合成步骤回答问题:
(1)球形冷凝管中冷凝水的进口为_______ (填“a”或“b”)。
(2)先将饱和 溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器A中缓慢滴入30%
溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器A中缓慢滴入30% 溶液,在磁力搅拌下充分反应。这一步的关键是控制温度不能太高,其原因是
溶液,在磁力搅拌下充分反应。这一步的关键是控制温度不能太高,其原因是_______ 。
(3)过碳酸钠样品中 含量的测定。
含量的测定。
①准确称量0.1000g过碳酸钠样品于250mL锥形瓶中,加入50mL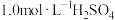 溶液溶解后,用
溶液溶解后,用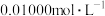 酸性
酸性 标准溶液滴定至终点。
标准溶液滴定至终点。
②下表是实验数据记录:
产品中 的质量分数为
的质量分数为_______ 。
③下列操作会使测量结果偏大的是_______ 。
A.滴定管尖嘴开始有气泡,滴定终点气泡消失 B.滴定管未用酸性 标准液润洗
标准液润洗
C.锥形瓶未干燥即盛放待测液 D.滴定终点俯视读数
(4)某位同学向固体过碳酸钠中加入稀硫酸,发现有两种不同的气体产生,试写出其反应的化学方程式_______ 。注:写方程式时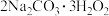 用括号,如系数为3则写成
用括号,如系数为3则写成
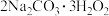 )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下(固定仪器已略去)。
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下(固定仪器已略去)。
已知:主反应:
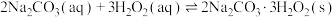

按下列合成步骤回答问题:
(1)球形冷凝管中冷凝水的进口为
(2)先将饱和
 溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器A中缓慢滴入30%
溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器A中缓慢滴入30% 溶液,在磁力搅拌下充分反应。这一步的关键是控制温度不能太高,其原因是
溶液,在磁力搅拌下充分反应。这一步的关键是控制温度不能太高,其原因是(3)过碳酸钠样品中
 含量的测定。
含量的测定。①准确称量0.1000g过碳酸钠样品于250mL锥形瓶中,加入50mL
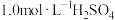 溶液溶解后,用
溶液溶解后,用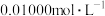 酸性
酸性 标准溶液滴定至终点。
标准溶液滴定至终点。②下表是实验数据记录:
| 滴定次数 | 1 | 2 | 3 | 4 |
 /mL /mL | 29.95 | 28.10 | 30.02 | 30.03 |
 的质量分数为
的质量分数为③下列操作会使测量结果偏大的是
A.滴定管尖嘴开始有气泡,滴定终点气泡消失 B.滴定管未用酸性
 标准液润洗
标准液润洗C.锥形瓶未干燥即盛放待测液 D.滴定终点俯视读数
(4)某位同学向固体过碳酸钠中加入稀硫酸,发现有两种不同的气体产生,试写出其反应的化学方程式
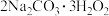 用括号,如系数为3则写成
用括号,如系数为3则写成
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.某学生用已知物质的量浓度的NaOH标准溶液来测定未知物质的量浓度的盐酸时,选择甲基橙作指示剂。请回答下列问题:
(1)配制480mL0.1000mol•L-1NaOH标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、_____ 、_____ 等。
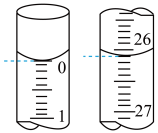
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为____ mL。
(3)下列有关本实验滴定说法不正确的是_____ 。

A.用酸式滴定管量取25.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴甲基橙试液后进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液
E.碱式滴定管尖嘴部分有气泡,滴定后消失会造成测定结果偏高
F.根据突变范围指示剂最好选择甲基橙误差最小
(4)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算,该盐酸溶液的物质的量浓度为_____ 。
II.氧化还原滴定实验与酸碱中和滴定类似。某学习小组用“间接硝量法”测定含有CuCl2•2H2O晶体试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应2Cu2++4I-=2CuI↓+I2。用0.1000mol/LNa2S2O3标准溶液滴定,I2+2S2O =S4O
=S4O +2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
+2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
(5)可选用_____ 作滴定指示剂,滴定终点的现象是_____ 。
(6)该试样中CuCl2•2H2O(M=171g/mol)的质量百分数为_____ 。
(1)配制480mL0.1000mol•L-1NaOH标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为

(3)下列有关本实验滴定说法不正确的是

A.用酸式滴定管量取25.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴甲基橙试液后进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液
E.碱式滴定管尖嘴部分有气泡,滴定后消失会造成测定结果偏高
F.根据突变范围指示剂最好选择甲基橙误差最小
(4)某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 29.61 |
| 第三次 | 25.00 | 0.22 | 26.31 |
II.氧化还原滴定实验与酸碱中和滴定类似。某学习小组用“间接硝量法”测定含有CuCl2•2H2O晶体试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应2Cu2++4I-=2CuI↓+I2。用0.1000mol/LNa2S2O3标准溶液滴定,I2+2S2O
 =S4O
=S4O +2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
+2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(5)可选用
(6)该试样中CuCl2•2H2O(M=171g/mol)的质量百分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定—已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用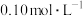 的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
(1)用______________ 滴定管(填“酸式”或“碱式”)盛装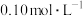 的盐酸标准液。
的盐酸标准液。
(2)试样中NaOH的质量分数为________________ 。
(3)若出现下列情况,测定结果偏高的是_________ (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点时,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
(4)滴定时,KMnO4溶液应装在______ 滴定管中(选填:酸式、碱式).
(5)滴定终点的判断方法是:______ .
(6)根据上述数据计算,该KMnO4溶液的浓度为______ mol/L.
(7)下列操作中使得KMnO4溶液浓度偏低的是______.
Ⅰ.酸碱中和滴定—已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用
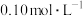 的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:滴定序号 |
| 所消耗盐酸标准液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0. 50 | 20. 60 |
2 | 25.00 | 6. 00 | 26. 00 |
3 | 25.00 | 1. 10 | 21.00 |
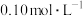 的盐酸标准液。
的盐酸标准液。(2)试样中NaOH的质量分数为
(3)若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点时,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 1.50 | 23.70 |
2 | 20.00 | 1.02 | 21.03 |
3 | 20.00 | 2.00 | 21.99 |
(5)滴定终点的判断方法是:
(6)根据上述数据计算,该KMnO4溶液的浓度为
(7)下列操作中使得KMnO4溶液浓度偏低的是______.
| A.滴定管用水洗净后直接注入KMnO4溶液 |
| B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.滴定管内在滴定前有气泡,滴定后气泡消失 |
| D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】随着人类社会的发展,氮氧化物的排放导致一系列环境问题。
(1) 加速臭氧层被破坏,其反应过程如图所示:
加速臭氧层被破坏,其反应过程如图所示:
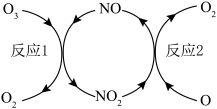
反应
反应1:
反应2:热化学方程式为_________ 。
(2)①汽车发动机工作时会引发反应 .
. 时,向固定容积的密闭容器中充入等物质的量的
时,向固定容积的密闭容器中充入等物质的量的 和
和 发生上述反应,下列能说明反应已达到平衡状态的是
发生上述反应,下列能说明反应已达到平衡状态的是_________ .
A. 混合气体的密度保持不变 B.
C.混合气体的平均相对分子质量不变 D. 的浓度不再发生变化
的浓度不再发生变化
反应过程各组分体积分数( )的变化如图3所示,
)的变化如图3所示, 的平衡转化率为
的平衡转化率为_________ .
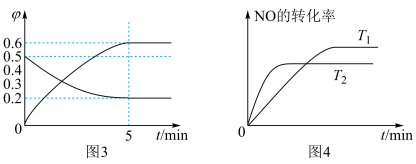
②在密闭、固定容积的容器中,一定量 发生分解的过程中,
发生分解的过程中, 的转化率随时间变化关系如图4所示。反应
的转化率随时间变化关系如图4所示。反应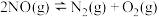

_________ 0(填“>”或“<”).
(3)电解 制备
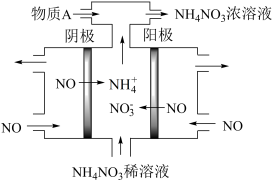
制备 ,是处理氮氧化物的排放的方法之一,发生反
,是处理氮氧化物的排放的方法之一,发生反 ,其工作原理如图所示:阴极的电极反应式为:
,其工作原理如图所示:阴极的电极反应式为:_________ 。
(4)电解质的水溶液中可能存在多样平衡。
醋酸是常见的弱酸。用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
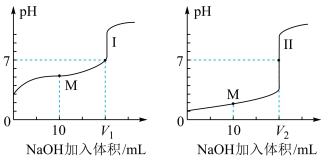
①滴定醋酸的曲线是_________ (填“I”或“Ⅱ”)。② 和
和 的关系:
的关系:
_________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
③曲线Ⅰ的M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________ .
(1)
 加速臭氧层被破坏,其反应过程如图所示:
加速臭氧层被破坏,其反应过程如图所示:
反应

反应1:

反应2:热化学方程式为
(2)①汽车发动机工作时会引发反应
 .
. 时,向固定容积的密闭容器中充入等物质的量的
时,向固定容积的密闭容器中充入等物质的量的 和
和 发生上述反应,下列能说明反应已达到平衡状态的是
发生上述反应,下列能说明反应已达到平衡状态的是A. 混合气体的密度保持不变 B.

C.混合气体的平均相对分子质量不变 D.
 的浓度不再发生变化
的浓度不再发生变化反应过程各组分体积分数(
 )的变化如图3所示,
)的变化如图3所示, 的平衡转化率为
的平衡转化率为
②在密闭、固定容积的容器中,一定量
 发生分解的过程中,
发生分解的过程中, 的转化率随时间变化关系如图4所示。反应
的转化率随时间变化关系如图4所示。反应

(3)电解
 制备
制备 ,是处理氮氧化物的排放的方法之一,发生反
,是处理氮氧化物的排放的方法之一,发生反 ,其工作原理如图所示:阴极的电极反应式为:
,其工作原理如图所示:阴极的电极反应式为:
(4)电解质的水溶液中可能存在多样平衡。
醋酸是常见的弱酸。用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是
 和
和 的关系:
的关系:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。③曲线Ⅰ的M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室可用二氧化锰和浓盐酸共热制取氯气。为了证明得到的氯气中含氯化氢,并测定氯化氢的含量进行了下列实验。请回答:
(1)向饱和NaCl溶液中滴入少量浓盐酸,会有白色晶体析出,该晶体的化学式是_____ 。
(2)按如图装置,将所得气体通入后,试管内白色晶体析出,能否证明氯气中含有HCl,说明理由_____ 。b装置的作用是_____ 。
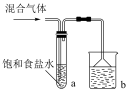
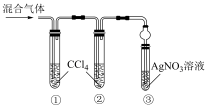
(3)已知氯气易溶于CCl4,按图中装置实验试管③中有白色沉淀,能够证明含HCl,说明理由_____ 。用浓盐酸与二氧化锰加热经干燥得到1.12L(标况下)气体,除去Cl2后,用水全部吸收并定容至100mL,再通过滴定测HCl气体含量。
(4)定容所需要仪器有烧杯、玻璃棒、________ 和_____ 。
(5)取定容后溶液20.00mL,加入2滴酚酞试液,用0.0250mol/L标准NaOH溶液滴定,当______ 即为滴定终点,消耗NaOH溶液19.20mL,则得到的气体中氯化氢的体积含量是______ 。
(1)向饱和NaCl溶液中滴入少量浓盐酸,会有白色晶体析出,该晶体的化学式是
(2)按如图装置,将所得气体通入后,试管内白色晶体析出,能否证明氯气中含有HCl,说明理由

(3)已知氯气易溶于CCl4,按图中装置实验试管③中有白色沉淀,能够证明含HCl,说明理由

(4)定容所需要仪器有烧杯、玻璃棒、
(5)取定容后溶液20.00mL,加入2滴酚酞试液,用0.0250mol/L标准NaOH溶液滴定,当
您最近一年使用:0次




