工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:
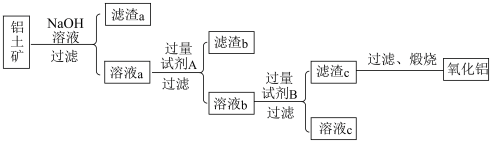
(1)滤渣a中除含泥沙外,一定含有____ ,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________ 。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________ ,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________ 。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________ 。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________ (填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______ 来制取A1(OH)3。

(1)滤渣a中除含泥沙外,一定含有
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有
更新时间:2018-03-04 14:14:46
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以冶炼铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)写出铝灰与硫酸反应涉及的主要离子方程式_______ 。
(2)图中“滤渣”的主要成分为_______ (填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为_______ 。
(4)已知:铁氰化钾化学式为 K3[Fe(CN)6];亚铁氰化钾化学式为 K4[Fe(CN)6]。
3Fe2+ + 2[Fe(CN)6]3-= Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3+ + 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是_______ (可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、 KSCN溶液)
(5)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是_______ (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有_______ (填化学式)。
③KMnO4溶液褪色(MnO 被还原为Mn2+),发生的离子反应方程式为
被还原为Mn2+),发生的离子反应方程式为_______ 。

(1)写出铝灰与硫酸反应涉及的主要离子方程式
(2)图中“滤渣”的主要成分为
(3)加30%H2O2溶液发生的离子反应方程式为
(4)已知:铁氰化钾化学式为 K3[Fe(CN)6];亚铁氰化钾化学式为 K4[Fe(CN)6]。
3Fe2+ + 2[Fe(CN)6]3-= Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3+ + 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(5)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]
 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
①集气瓶中收集到的气体是
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有
③KMnO4溶液褪色(MnO
 被还原为Mn2+),发生的离子反应方程式为
被还原为Mn2+),发生的离子反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】叠氮化钠( )常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:
)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:

①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并与氨气充分反应后,停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210∼220℃,然后通入 。
。
④冷却,向产物中加入乙醇(降低 的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
已知:Ⅰ. 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
Ⅱ. 熔点210℃,沸点400℃,在水溶液中易水解。
熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为_______ ;步骤①中先加热通 一段时间的目的是
一段时间的目的是_______ 。
(2)步骤②氨气与熔化的钠反应生成 的化学方程式为
的化学方程式为_______ 。
(3)生成 的化学方程式为
的化学方程式为_______ 。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_______ 。
(5)步骤④中用乙醚洗涤的主要目的是_______ 。
(6)汽车经撞击后30毫秒内,会引发 迅速分解成两种单质,其中氧化产物和还原产物的质量之比为
迅速分解成两种单质,其中氧化产物和还原产物的质量之比为_______ 。
 )常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:
)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并与氨气充分反应后,停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210∼220℃,然后通入
 。
。④冷却,向产物中加入乙醇(降低
 的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。已知:Ⅰ.
 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;Ⅱ.
 熔点210℃,沸点400℃,在水溶液中易水解。
熔点210℃,沸点400℃,在水溶液中易水解。请回答下列问题:
(1)装置B中盛放的药品为
 一段时间的目的是
一段时间的目的是(2)步骤②氨气与熔化的钠反应生成
 的化学方程式为
的化学方程式为(3)生成
 的化学方程式为
的化学方程式为(4)图中仪器a用的是铁质而不用玻璃,其主要原因是
(5)步骤④中用乙醚洗涤的主要目的是
(6)汽车经撞击后30毫秒内,会引发
 迅速分解成两种单质,其中氧化产物和还原产物的质量之比为
迅速分解成两种单质,其中氧化产物和还原产物的质量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】绿色化学是当前化学研究的热点,为了实现经济可持续性发展,充分利用资源,某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少 、
、 、MgO和
、MgO和 等杂质)制备四氢铝锂(
等杂质)制备四氢铝锂( )和冰晶石(
)和冰晶石(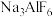 )。四氢铝锂是有机合成的重要还原剂,冰晶石常用作工业上冶炼铝的助熔剂。其工艺流程如下:
)。四氢铝锂是有机合成的重要还原剂,冰晶石常用作工业上冶炼铝的助熔剂。其工艺流程如下:

请回答下列问题:
(1)为了提高酸浸效率,除了升高温度外,还可以采取哪些方式,写出两种可行的方法_______ 。
(2)滤渣2的主要成分是_______ 。
(3) 溶于水导电,但熔融时不导电的原因是
溶于水导电,但熔融时不导电的原因是_______ 。
(4)写出滤液2与足量 反应的离子方程式
反应的离子方程式_______ 。
(5)写出由 制备冰晶石的化学方程式
制备冰晶石的化学方程式_______ ,该反应不能在玻璃容器中进行的原因是_______ (用化学方程式来解释)。
(6)四氢铝锂具有很好的还原性,与水反应可生成两种碱,写出对应的化学方程式______ 。
 、
、 、MgO和
、MgO和 等杂质)制备四氢铝锂(
等杂质)制备四氢铝锂( )和冰晶石(
)和冰晶石(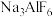 )。四氢铝锂是有机合成的重要还原剂,冰晶石常用作工业上冶炼铝的助熔剂。其工艺流程如下:
)。四氢铝锂是有机合成的重要还原剂,冰晶石常用作工业上冶炼铝的助熔剂。其工艺流程如下:
请回答下列问题:
(1)为了提高酸浸效率,除了升高温度外,还可以采取哪些方式,写出两种可行的方法
(2)滤渣2的主要成分是
(3)
 溶于水导电,但熔融时不导电的原因是
溶于水导电,但熔融时不导电的原因是(4)写出滤液2与足量
 反应的离子方程式
反应的离子方程式(5)写出由
 制备冰晶石的化学方程式
制备冰晶石的化学方程式(6)四氢铝锂具有很好的还原性,与水反应可生成两种碱,写出对应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):
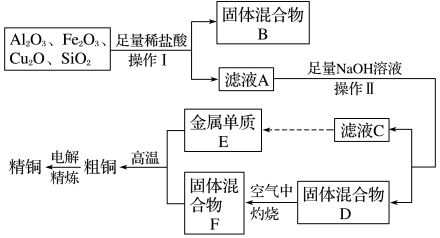
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是_____ 。它与NaOH溶液反应的离子方程式为_____ 。
(2)滤液A中铁元素的存在形式为_____ (填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____ 。要检验该铁元素的离子的实验_____
(3)在滤液C中通入足量CO2的离子方程式为_____
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为_____

已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是
(2)滤液A中铁元素的存在形式为
(3)在滤液C中通入足量CO2的离子方程式为
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
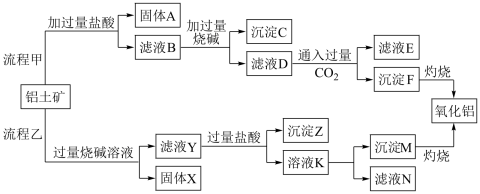
(1)流程甲中加入盐酸后生成Fe3+的离子方程式为____________ ;固体A_____ (填化学式),写出沉淀F转化为氧化铝的化学方程式是_______________ 。
(2)流程乙中向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是______ 、________ ;沉淀Z为_______ (填化学式)。由溶液K生成沉淀M的离子方程式是__________ 。
(3)流程乙中将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________ (保留一位小数)。
(4)工业上制取AlCl3:用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是______ 。

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为
(2)流程乙中向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是
(3)流程乙中将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是
(4)工业上制取AlCl3:用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能。赤泥是铝土矿加工过程中产生的废料,含有丰富的钪元素,另含有 、
、 、
、 等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示(
等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示( 是一种磷酸酯萃取剂)。
是一种磷酸酯萃取剂)。
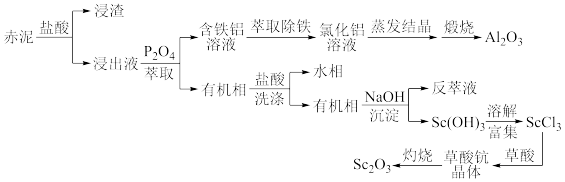
回答下列问题:
(1)写出赤泥经盐酸处理后所得“浸渣”的一种用途:___________ 。
(2)写出工艺流程中“蒸发结晶”过程发生的化学反应方程式:___________ 。
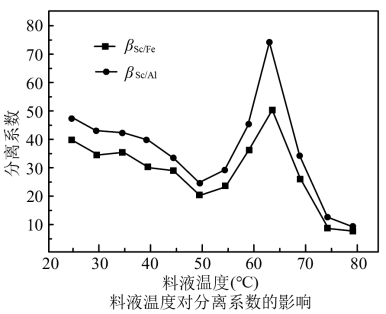
(3) 萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时
萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时 最佳浓度及料液温度分别为
最佳浓度及料液温度分别为_______ 、_______ ;萃取后“盐酸洗涤”的目的是_______ 。
 浓度对萃取率的影响如下表:
浓度对萃取率的影响如下表:
料液温度对分离系数的影响如下图:
(4)反萃取时, 完全沉淀(浓度为
完全沉淀(浓度为 )时,反萃液的pH为
)时,反萃液的pH为___________ 。(已知: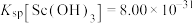 ,
, ,结果保留小数点后两位)
,结果保留小数点后两位)
(5)为探究所得草酸钪晶体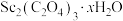 中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69g
中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69g 固体,则
固体,则
___________ 。
(6)草酸钪晶体灼烧分解反应方程式为______ ,其固体副产物主要为______ 。
 、
、 、
、 等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示(
等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示( 是一种磷酸酯萃取剂)。
是一种磷酸酯萃取剂)。
回答下列问题:
(1)写出赤泥经盐酸处理后所得“浸渣”的一种用途:
(2)写出工艺流程中“蒸发结晶”过程发生的化学反应方程式:
(3)
 萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时
萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时 最佳浓度及料液温度分别为
最佳浓度及料液温度分别为 浓度对萃取率的影响如下表:
浓度对萃取率的影响如下表:| 试验编号 |  浓度/% 浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1-1 | 1 | 分相快 | 90.76 | 15.82 |
| 1-2 | 2 | 分相容易 | 91.53 | 19.23 |
| 1-3 | 3 | 分相容易 | 92.98 | 13.56 |
| 1-4 | 4 | 有第三相 | 90.69 | 30.12 |
| 1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |
料液温度对分离系数的影响如下图:

(4)反萃取时,
 完全沉淀(浓度为
完全沉淀(浓度为 )时,反萃液的pH为
)时,反萃液的pH为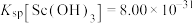 ,
, ,结果保留小数点后两位)
,结果保留小数点后两位)(5)为探究所得草酸钪晶体
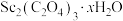 中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69g
中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69g 固体,则
固体,则
(6)草酸钪晶体灼烧分解反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】丁烷催化裂解生成烷烃和烯烃,可按下列两种方式进行:C4H10→C2H4+C2H6;C4H10→C H4+C3H6某化学兴趣小组为了测定丁烷裂解气中CH4和C2H6的比例关系,设计实验如下图所示:
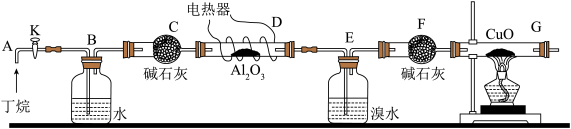
如图连接好装置后,需进行的操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
注:CuO能将烃氧化成CO2和H2O;Al2O3是烷烃裂解的催化剂;G后面装置已省略。
(1)这三步操作的先后顺序是_________ (填序号)
(2)简要叙述证明空气已排尽的操作方法______________________ 。
(3)假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中CH4和C2H6的物质的量之比n(CH4):n(C2H6)=______________ 。
(4)若对实验后E装置中的混合物再按以下流程进行实验:

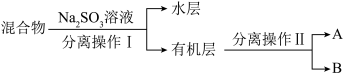
①分离操作I、II的名称分别是:I、_____________ ,II、____________ 。
②Na2SO3溶液的作用是______________________ 。

如图连接好装置后,需进行的操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
注:CuO能将烃氧化成CO2和H2O;Al2O3是烷烃裂解的催化剂;G后面装置已省略。
(1)这三步操作的先后顺序是
(2)简要叙述证明空气已排尽的操作方法
(3)假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中CH4和C2H6的物质的量之比n(CH4):n(C2H6)=
(4)若对实验后E装置中的混合物再按以下流程进行实验:


①分离操作I、II的名称分别是:I、
②Na2SO3溶液的作用是
您最近一年使用:0次
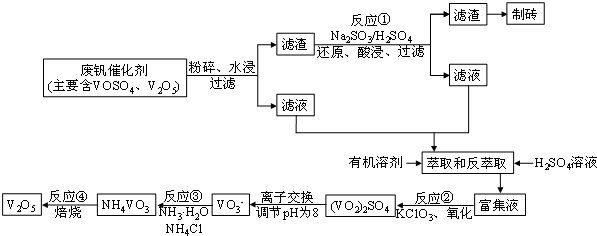
【推荐2】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。该工艺的主要流程如图所示:
已知部分含钒物质在水中的溶解性如下表所示:
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为____ 。
(2)滤液中含钒的主要成分________ (写化学式)。反应①的离子方程式___________________ 。
(3)萃取和反萃取过程中所需的主要玻璃仪器为_____________ 。若反萃取使用硫酸用量过大,进一步处理会增加_______ (填化学式)的用量,造成成本增大。
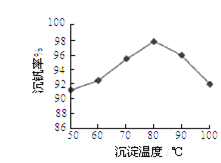
(4)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式___________________ 。“沉淀”过程中,沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO3-的质量比)等的影响,其中温度与沉钒率的关系如图所示,温度高于80℃沉钒率降低的可能原因是___________________________ 。
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,③中加入氨水,调节溶液的最佳pH值为____ 。若矾沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____ 。(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(6)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5)。取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1mol•L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是______________ 。

已知部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为
(2)滤液中含钒的主要成分
(3)萃取和反萃取过程中所需的主要玻璃仪器为
(4)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式

(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,③中加入氨水,调节溶液的最佳pH值为
(6)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5)。取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1mol•L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是
您最近一年使用:0次
【推荐3】以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回 收 V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1) “酸浸”时 V2O5转化为 ,反应的离子方程式为
,反应的离子方程式为_______________________ , 同时 V2O4转化成VO2+。“废渣 1”的主要成分是__________________ 。
(2)“氧化”中欲使 3 mol 的VO2+变为 ,则需要氧化剂KClO3至少为
,则需要氧化剂KClO3至少为________ mol。
(3)“中和”作用之一是使钒以 形式存在于溶液中。“废渣 2”中含有
形式存在于溶液中。“废渣 2”中含有__________ 。
(4)“流出液”中阳离子最多的是______________________________ 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式________________________________________________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1) “酸浸”时 V2O5转化为
 ,反应的离子方程式为
,反应的离子方程式为(2)“氧化”中欲使 3 mol 的VO2+变为
 ,则需要氧化剂KClO3至少为
,则需要氧化剂KClO3至少为(3)“中和”作用之一是使钒以
 形式存在于溶液中。“废渣 2”中含有
形式存在于溶液中。“废渣 2”中含有(4)“流出液”中阳离子最多的是
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式
您最近一年使用:0次



