我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______ 。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________ 。
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:_______ 。
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______ ,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____ ,N的杂化方式为________ ,写出NH3的一种等电子体___________ 。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________ 。
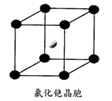
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是__ pm.(写出表达式即可)
(1)写出Cr的外围电子排布式
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是
更新时间:2018-05-14 15:20:01
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是_______ (填序号)。
A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为_______ ;光气(COCl2)各原子最外层都满 足8电子稳定结构,则光气分子的空间构型为_______ (用文字描述);
(3)Cu 2+基态的电子排布式为_______ ;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,硫酸根离子中硫原子的杂化方式为_______ ;不考虑空间构型,其内界结构可用示意图表示为_______ 。
(1)下列说法正确的是

A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
(3)Cu 2+基态的电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.完成下列问题
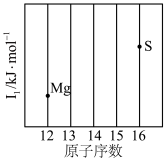
(1)依据第3周期元素第一电离能的变化规律,参照如图Mg、S元素的位置,用小黑点标出Al、Si、P三种元素的相对位置________ 。
Ⅱ.元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
(2)通过分析电负性的变化规律,确定Mg元素电负性的最小范围___________ 。
(3)下列物质属于离子化合物的是___________
(1)依据第3周期元素第一电离能的变化规律,参照如图Mg、S元素的位置,用小黑点标出Al、Si、P三种元素的相对位置

Ⅱ.元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
| 元素 | Al | Be | Mg | C | Cl | Na | Li | N | Si | O | H |
| O电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
(2)通过分析电负性的变化规律,确定Mg元素电负性的最小范围
(3)下列物质属于离子化合物的是___________
| A.BeCl2 | B.Li3N | C.HCl | D.CCl4 |
您最近一年使用:0次
【推荐3】开发新型储氢材料是开发利用氢能的重要研究方向。
(1) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为______ ,该电子层具有的原子轨道数为 _______ 。
②Li、B、H元素的电负性由大到小的排列顺序为___________ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+___________ (填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
则M是______________ (填元素名称)。
(1)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①基态Cl原子中,电子占据的最高电子层符号为
②Li、B、H元素的电负性由大到小的排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
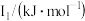 | 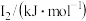 | 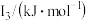 | 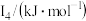 | 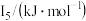 |
| 738 | 1451 | 7733 | 10540 | 13630 |
则M是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】简要回答或计算。
(1)Bi2Cl 离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型
离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型______ 。
(2)在液氨中,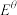 (Na+/Na)=-1.89V,
(Na+/Na)=-1.89V,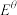 (Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因
(Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因_______ 。
(3)将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。在此溶液中插入两块铅电极,通直流电,当1.0mol电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅____ ?写出沉积铅的量____ 。
(4)下图是某金属氧化物的晶体结构示意图。图中,小球代表金属原子,大球代表氧原子,细线框处是其晶胞。
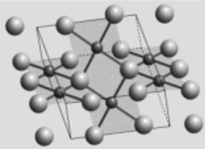
①写出金属原子的配位数(m)和氧原子的配位数(n):_______ 。
②写出晶胞中金属原子数(p)和氧原子数(q):________ 。
③写出该金属氧化物的化学式(金属用M表示)__________ 。
(5)向含[cis-Co(NH3)4(H2O)2]3+的溶液中加入氨水,析出含{Co[Co(NH3)4(OH)2]3}6+的难溶盐。{Co[Co(NH3)4(OH)2]3}6+是以羟基为桥键的多核络离子,具有手性。画出其结构____________ 。
(6)向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X(154.9g·mol-1)。X为暗红色液体,沸点117°C,有强刺激性臭味,遇水冒白烟,遇硫燃烧。X分子有两个相互垂直的镜面,两镜面的交线为二重旋转轴。写出X的化学式并画出其结构式___________ 。
(7)实验得到一种含钯化合物Pd[CxHyNz](ClO4)2,该化合物中C和H的质量分数分别为30.15%和5.06%。将此化合物转化为硫氰酸盐Pd[CxHyNz](SCN)2,则C和H的质量分数分别为40.46%和5.94%。通过计算确定Pd[CxHyNz](ClO4)2的组成___________ 。
(8)甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一定比例混合,氧气的利用率为85%,计算汽车尾气中O2、CO2、H2O和N2的体积比________ 。(空气中O2和N2体积比按21:79计;设尾气中CO2的体积为1)。
(1)Bi2Cl
 离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型
离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi原子的杂化轨道类型(2)在液氨中,
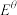 (Na+/Na)=-1.89V,
(Na+/Na)=-1.89V,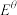 (Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因
(Mg2++Mg)=-1.74V,但可以发生Mg置换Na的反应:Mg+2NaI=MgI2+2Na。指出原因(3)将Pb加到氨基钠的液氨溶液中,先生成白色沉淀Na4Pb,随后转化为Na4Pb9(绿色)而溶解。在此溶液中插入两块铅电极,通直流电,当1.0mol电子通过电解槽时,在哪个电极(阴极或阳极)上沉积出铅
(4)下图是某金属氧化物的晶体结构示意图。图中,小球代表金属原子,大球代表氧原子,细线框处是其晶胞。

①写出金属原子的配位数(m)和氧原子的配位数(n):
②写出晶胞中金属原子数(p)和氧原子数(q):
③写出该金属氧化物的化学式(金属用M表示)
(5)向含[cis-Co(NH3)4(H2O)2]3+的溶液中加入氨水,析出含{Co[Co(NH3)4(OH)2]3}6+的难溶盐。{Co[Co(NH3)4(OH)2]3}6+是以羟基为桥键的多核络离子,具有手性。画出其结构
(6)向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X(154.9g·mol-1)。X为暗红色液体,沸点117°C,有强刺激性臭味,遇水冒白烟,遇硫燃烧。X分子有两个相互垂直的镜面,两镜面的交线为二重旋转轴。写出X的化学式并画出其结构式
(7)实验得到一种含钯化合物Pd[CxHyNz](ClO4)2,该化合物中C和H的质量分数分别为30.15%和5.06%。将此化合物转化为硫氰酸盐Pd[CxHyNz](SCN)2,则C和H的质量分数分别为40.46%和5.94%。通过计算确定Pd[CxHyNz](ClO4)2的组成
(8)甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一定比例混合,氧气的利用率为85%,计算汽车尾气中O2、CO2、H2O和N2的体积比
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)四种晶体的熔点数据如表:
互为同分异构体的硝基化合物与氨基酸,前者熔点低于后者的主要原因是____ 。
(2)用质谱仪检测氯化铝时,谱图中出现质荷比(相对分子质量)为267的峰,原因是____ 。
(1)四种晶体的熔点数据如表:
| 物质 | CH3CH2NO2 | CH3CH2CH2NO2 | H2NCH2COOH | H2NCH(CH3)COOH |
| 熔点/℃ | -90 | -108 | 240 | 314 |
互为同分异构体的硝基化合物与氨基酸,前者熔点低于后者的主要原因是
(2)用质谱仪检测氯化铝时,谱图中出现质荷比(相对分子质量)为267的峰,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下列反应曾用于检测司机是否酒后驾驶:
(1)Cr3+基态核外电子排布式为_______ ;配合物[Cr(H2O)6]3+中,与 Cr3+形成配位键的原子是_______ (填元素符号)。
(2)CH3COOH 中C 原子轨道杂化类型为_______ ,1mol CH3CH2OH含有的σ键的数目为_______ 。
(3)与H2O互为等电子体的一种阳离子为_______ (填化学式);H2O与CH3CH2OH 可以任意比例互溶,除因为它们都是极性分子外,还因为_______ 。

(1)Cr3+基态核外电子排布式为
(2)CH3COOH 中C 原子轨道杂化类型为
(3)与H2O互为等电子体的一种阳离子为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1)氢化铝钠( )是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。
)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有___________ 个; 晶体的密度为
晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。

(2)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为___________ ,Mo原子周围与之等距离的Mo原子个数为___________ 。
(3)ZnS的晶胞结构如图所示:晶体中 填充在
填充在 围成的四面体空隙中,则四面体空隙的填充率为
围成的四面体空隙中,则四面体空隙的填充率为___________ ;已知ZnS的晶胞密度是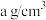 ,则
,则 与
与 的最短距离为
的最短距离为___________ pm(用含a、 的代数式表示)。
的代数式表示)。

(4)已知Co可形成晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为___________ 。

(1)氢化铝钠(
 )是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。
)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。 晶体中,与
晶体中,与 紧邻且等距的
紧邻且等距的 有
有 晶体的密度为
晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(2)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为
(3)ZnS的晶胞结构如图所示:晶体中
 填充在
填充在 围成的四面体空隙中,则四面体空隙的填充率为
围成的四面体空隙中,则四面体空隙的填充率为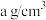 ,则
,则 与
与 的最短距离为
的最短距离为 的代数式表示)。
的代数式表示)。
(4)已知Co可形成晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为

您最近一年使用:0次
【推荐2】C、Si元素组成的一些单质或化合物在科研领域中具有重要的作用。请回答下列问题。
(1)硅原子价层电子的轨道表示式中能量最低的是___________。
(2)由C、H、N可以形成化合物 ,C、H、N电负性大小顺序为
,C、H、N电负性大小顺序为___________ 。
(3)Si与一些金属可以形成不同化合物,如图是Si与Al、Li形成的某化合物的晶胞示意图。已知晶胞棱长为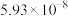 cm,Si与Al之间的共价键键长是
cm,Si与Al之间的共价键键长是___________ cm(只要求列算式,不必计算出数值)。
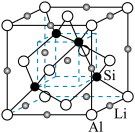
(1)硅原子价层电子的轨道表示式中能量最低的是___________。
A. | B. | C. | D. |
 ,C、H、N电负性大小顺序为
,C、H、N电负性大小顺序为(3)Si与一些金属可以形成不同化合物,如图是Si与Al、Li形成的某化合物的晶胞示意图。已知晶胞棱长为
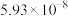 cm,Si与Al之间的共价键键长是
cm,Si与Al之间的共价键键长是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是___________ 。
(2)[H2F]++[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为___________ 。阳离子[H2F]+的空间构型为___________ ,写出[H2F]+的等电子体___________ (分子和离子各举一例)。
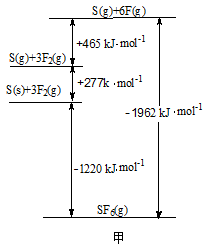
(3) SF6被广泛用于高压电器设备的绝缘介质。根据___________ 理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图甲计算键能,则S-F的键能为___________ kJ·mol-1。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g·mol-1的数据,原因是___________ 。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在___________ (填序号)。
a.离子键 b.极性键 c.配位键d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为___________ (用元素符号表示)。
(5) NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___________ 。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),已知O2-的华径为a pm,每平方米面积上分散的该晶体的质量为___________ g(用含a、NA的代数式表示)。

(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是
(2)[H2F]++[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为
(3) SF6被广泛用于高压电器设备的绝缘介质。根据

(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g·mol-1的数据,原因是
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在
a.离子键 b.极性键 c.配位键d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为
(5) NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),已知O2-的华径为a pm,每平方米面积上分散的该晶体的质量为

您最近一年使用:0次



