用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4·H2O(三盐),主要制备流程如下。
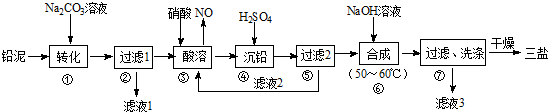
请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为__________ 。
(2)将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为______________________ 。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液2中溶质的主要成分为______ (填化学式)。
(4)步骤⑥合成三盐的化学方程式为______________________ 。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是__________________ 。

请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4
 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为(2)将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液2中溶质的主要成分为
(4)步骤⑥合成三盐的化学方程式为
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是
更新时间:2018-10-28 14:12:24
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】一种以生石灰(CaO)为原料制备KClO3的流程如图:
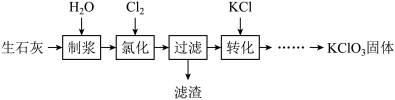
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO3)2。
回答下列问题:
(1)氯化过程中须缓慢通入Cl2
①缓慢通入Cl2的目的是_____ 。
②Cl2与Ca(OH)2作用生成Ca(ClO3)2的化学方程式为_____ 。
(2)实验室模拟工业生产,把氯气通入石灰乳中,发现氯化后,生成物中含有Cl-、ClO-、ClO 三种含氯元素的离子,其中ClO-、ClO
三种含氯元素的离子,其中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
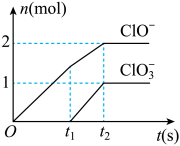
①t2时,Cl2与石灰乳主要成分Ca(OH)2发生反应的离子方程式为_____ ,则石灰乳中参加反应Ca(OH)2的物质的量是_____ mol。
②据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入Cl2的速度不同,ClO-和ClO 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后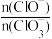
_____ (填“>”“<”或“=”)2。
③氯酸钙[Ca(ClO3)2]为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。把氯气通入石灰乳中制备漂白粉,为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施______ (写一条即可)。

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO3)2。
回答下列问题:
(1)氯化过程中须缓慢通入Cl2
①缓慢通入Cl2的目的是
②Cl2与Ca(OH)2作用生成Ca(ClO3)2的化学方程式为
(2)实验室模拟工业生产,把氯气通入石灰乳中,发现氯化后,生成物中含有Cl-、ClO-、ClO
 三种含氯元素的离子,其中ClO-、ClO
三种含氯元素的离子,其中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
①t2时,Cl2与石灰乳主要成分Ca(OH)2发生反应的离子方程式为
②据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入Cl2的速度不同,ClO-和ClO
 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后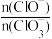
③氯酸钙[Ca(ClO3)2]为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。把氯气通入石灰乳中制备漂白粉,为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________ 。
(2)“滤液②”中含有的金属离子是______________ 。
(3)“转化”中可替代H2O2的物质是______________ 。若工艺流程改为先“调pH”后“转化”,即
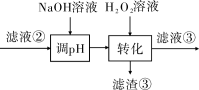
“滤液③”中可能含有的杂质离子为______________ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________ (列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是______________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01 mol·L−1)的pH 沉淀完全时(c=1.0×10−5 mol·L−1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代H2O2的物质是

“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算Ni(OH)2的Ksp=
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上用铝土矿(主要成分为Al2O3,含有少量SiO2、FeO·xFe2O3等杂质)制取铝的一种工艺流程示意图如下:
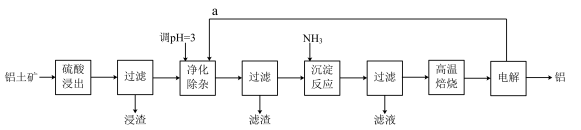
已知:生成氢氧化物沉淀的pH如下表。
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_______________
(2)浸渣的主要成分为____________________
(3)净化除杂操作分为两步:第一步是通入气体a,其目的是_____________________ 。第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化除杂生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________
(4)写出沉淀反应操作中发生反应的离子方程式:________________________ 。
(5)实验室高温焙烧时,用于盛放固体的仪器名称是_______________ 。
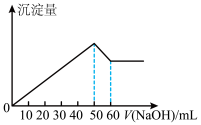
(6)在AlCl3和MgCl2的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原溶液中AlCl3和MgCl2的物质的量之比为__________ ,并写出加入NaOH溶液的体积为50-60mL时的化学反应方程式__________________________ 。

已知:生成氢氧化物沉淀的pH如下表。
沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH | 3.2 | 5.2 | 12.4 |
(2)浸渣的主要成分为
(3)净化除杂操作分为两步:第一步是通入气体a,其目的是
(4)写出沉淀反应操作中发生反应的离子方程式:
(5)实验室高温焙烧时,用于盛放固体的仪器名称是
(6)在AlCl3和MgCl2的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原溶液中AlCl3和MgCl2的物质的量之比为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】CuCl2、CuCl广泛用于有机合成的催化剂。CuCl2容易潮解; CuCl白色粉末,微溶于水,溶于浓盐酸和氨水生成络合物,不溶于乙醇。
已知:
i.CuCl2+Cu+2HCl(浓) 2H[CuCl2](无色)
2H[CuCl2](无色) 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
ii.副反应:CuCl+H2O CuOH+2HCl;CuCl+Cl-=[CuCl2]-
CuOH+2HCl;CuCl+Cl-=[CuCl2]-
(1)制取CuCl2装置如下:
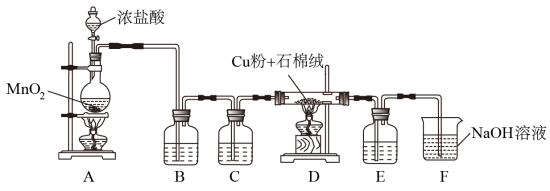
①A装置中发生反应的离子方程式是_________ 。
②C、E 装置中盛放的是浓硫酸,作用是_________ 。
③B中选择饱和食盐水而不用蒸馏水的原因是_________ 。
(2)制取CuCl流程如下:
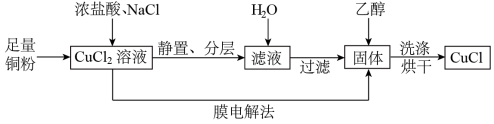
①反应①中加入NaCl的目的是_________ ;但是Cl—浓度过高,CuCl产率降低,原因是________________ 。
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为________________ 。
③利用膜电解法制取CuCl,阴极电极反应式为________________ 。
④用乙醇洗涤沉淀Y的原因为________________ 。
已知:
i.CuCl2+Cu+2HCl(浓)
 2H[CuCl2](无色)
2H[CuCl2](无色) 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HClii.副反应:CuCl+H2O
 CuOH+2HCl;CuCl+Cl-=[CuCl2]-
CuOH+2HCl;CuCl+Cl-=[CuCl2]-(1)制取CuCl2装置如下:

①A装置中发生反应的离子方程式是
②C、E 装置中盛放的是浓硫酸,作用是
③B中选择饱和食盐水而不用蒸馏水的原因是
(2)制取CuCl流程如下:

①反应①中加入NaCl的目的是
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为
③利用膜电解法制取CuCl,阴极电极反应式为
④用乙醇洗涤沉淀Y的原因为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】CIGS靶材是一种主要含铜、镓(Ga)、铟(In)、硒(Se)的合金,由于其良好的电学传导和光学透明性能,被广泛运用在薄膜太阳能电池领域。实验室设计从废弃CIGS中回收稀散金属铟和镓的氯化物(性质类似于AlCl3)的流程图:
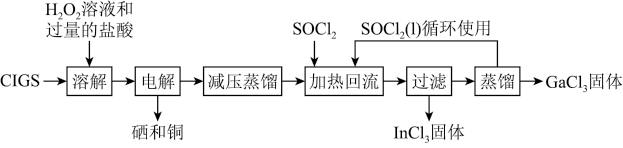
已知:
I.“溶解”步骤所得溶液中含有Cu2+、In3+、Ga3+和H2SeO3。
II.“减压蒸馏”步骤中得到InCl3·xH2O和GaCl3·yH2O固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期IIIA族,则其原子结构示意图为_______ 。
(2)“溶解”过程中生成Ga3+的离子方程式为_______ 和2Ga+6H+=2Ga3++3H2↑;溶解温度控制在30℃左右,温度不宜过高的原因是_______ 。利用王水也能溶解CIGS,试分析以王水代替HCl和H2O2的缺点是_______ (答出一点即可)。
(3)SOCl2与水反应,液面上有白雾形成,并生成一种能使品红溶液褪色的气体,SOCl2与水反应的方程式为:_______ ,则“加热回流”步骤中加入SOCl2的目的除了脱水外,还有_______ 。
(4)取mgCIGS靶材(其中镓的质量分数为a%),按上述流程进行实验,最终得到纯度为b%的GaCl3固体ng,则镓元素的回收率为_______ 。(用含m、n、a、b的代数式表示)。

已知:
I.“溶解”步骤所得溶液中含有Cu2+、In3+、Ga3+和H2SeO3。
II.“减压蒸馏”步骤中得到InCl3·xH2O和GaCl3·yH2O固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期IIIA族,则其原子结构示意图为
(2)“溶解”过程中生成Ga3+的离子方程式为
(3)SOCl2与水反应,液面上有白雾形成,并生成一种能使品红溶液褪色的气体,SOCl2与水反应的方程式为:
(4)取mgCIGS靶材(其中镓的质量分数为a%),按上述流程进行实验,最终得到纯度为b%的GaCl3固体ng,则镓元素的回收率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】溴化亚铜(CuBr)微溶于水,不溶于乙醇,可用作有机合成中的催化剂。实验室中可利用无水硫酸铜、溴化钠为主要原料制备溴化亚铜,制备流程如图:
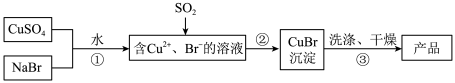
回答下列问题:
(1)过程②用到的玻璃仪器有___________ 。
(2)制备CuBr的反应在装置乙中进行,向其中加入32 g CuSO4和23 g NaBr配制成的150 mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。
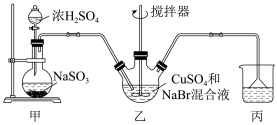
①装置甲中,不能采用浓度为98%的浓硫酸,一般采用浓度为70%左右的浓硫酸,其原因是___________ 。
②写出装置乙中发生反应的离子方程式:___________ ,该反应需保持反应液在60℃,最佳加热方式为___________ ,Cu2+、Br-反应完毕的标志是___________ 。
③丙中倒扣的漏斗可防止液体倒吸,下列装置中不能防止液体倒吸的是___________ (填标号)。
a.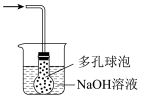 b.
b. 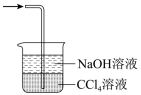 c.
c. 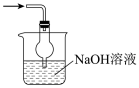 d.
d. 
(3)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是___________ 。
(4)最后经洗涤、干燥得到21.6 g产品,则该实验的产率是___________ 。

回答下列问题:
(1)过程②用到的玻璃仪器有
(2)制备CuBr的反应在装置乙中进行,向其中加入32 g CuSO4和23 g NaBr配制成的150 mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。

①装置甲中,不能采用浓度为98%的浓硫酸,一般采用浓度为70%左右的浓硫酸,其原因是
②写出装置乙中发生反应的离子方程式:
③丙中倒扣的漏斗可防止液体倒吸,下列装置中不能防止液体倒吸的是
a.
 b.
b.  c.
c.  d.
d. 
(3)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是
(4)最后经洗涤、干燥得到21.6 g产品,则该实验的产率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】现有M、N两种溶液,其中M溶液为无色溶液。经测定这两种溶液共含有下列10种离子:Cl-、Na+、K+、 、OH-、Fe2+、
、OH-、Fe2+、 、H+、
、H+、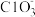 、
、 。
。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
(2)已知:酸性环境中,Fe2+被 氧化,生成Fe3+和NO气体,请写出对应的离子方程式:
氧化,生成Fe3+和NO气体,请写出对应的离子方程式:___________ ;结合(1)可判断出, 存在于
存在于 ___________ 溶液中。
(3)为了验证M溶液中是否含有Cl-,还需要补充的实验操作是(请用简单的文字说明)___________ 。
 、OH-、Fe2+、
、OH-、Fe2+、 、H+、
、H+、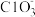 、
、 。
。(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | |
| ② | 确定M溶液中含有Na+,不含K+ |
| ③用pH试纸检测M溶液,pH试纸呈蓝色 |
 氧化,生成Fe3+和NO气体,请写出对应的离子方程式:
氧化,生成Fe3+和NO气体,请写出对应的离子方程式: 存在于
存在于 (3)为了验证M溶液中是否含有Cl-,还需要补充的实验操作是(请用简单的文字说明)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有一包固体粉末,其中可能含有K2CO3、Na2SO4、BaCl2、、Ba(NO3)2中的一种或几种。现按下列步骤进行实验。
(1)将部分该粉末溶于水,振荡,得无色溶液和白色沉淀
(2)向(1)的悬浊液中加入过量稀硝酸后,白色沉淀溶解,同时产生气泡
根据上述实验现象,可判断原固体粉末的组成可能是(有几种组合写几组):
①___________________________
②___________________________
③___________________________
写出(2)中反应的离子方程式_________________________________________
(3)欲进一步判断固体粉末的组成,可取少量(2)反应后的溶液,滴入_________ 溶液,如果溶液中_________ (填“有”或“没有”)白色沉淀产生,即可得到唯一结论
(1)将部分该粉末溶于水,振荡,得无色溶液和白色沉淀
(2)向(1)的悬浊液中加入过量稀硝酸后,白色沉淀溶解,同时产生气泡
根据上述实验现象,可判断原固体粉末的组成可能是(有几种组合写几组):
①
②
③
写出(2)中反应的离子方程式
(3)欲进一步判断固体粉末的组成,可取少量(2)反应后的溶液,滴入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
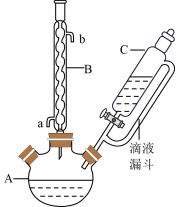
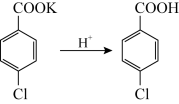
【推荐3】对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应原理和装置图如图:

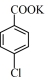 +MnO2
+MnO2
常温条件下的有关数据如表所示:
实验步骤:在装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
回答下列问题:
(1)装置A的名称是____ ,根据上述实验药品的用量,该装置的最适宜规格为____ (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在装置中仪器B的作用是____ 。
(3)控制温度为93℃左右的方法是____ 。
(4)滤液中加入稀硫酸酸化,可观察到的实验现象是____ 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是____ ,判断滤渣洗干净的操作和现象是____ 。
(6)本实验的产率是____ (保留3位有效数字)。


 +MnO2
+MnO2
常温条件下的有关数据如表所示:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
回答下列问题:
(1)装置A的名称是
A.100mL B.250mL C.500mL D.1000mL
(2)在装置中仪器B的作用是
(3)控制温度为93℃左右的方法是
(4)滤液中加入稀硫酸酸化,可观察到的实验现象是
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是
(6)本实验的产率是
您最近一年使用:0次



