Ⅰ.氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。以海绵铜(主要成分是Cu和少量CuO) 为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下:
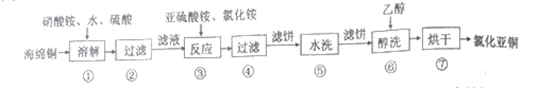
已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易氧化。回答下列问题:
(1)步骤①中N 元素被还原为最低价,则Cu溶解的离子方程式为
(2)步骤③中(NH4)SO3要适当过量,目的是使Cu2+充分还原,并保证Cu2+的还原速率和
(3)步骤⑥中醇洗的目的是
Ⅱ.以氧缺位铁酸铜(CuFe2O4-x)作催化剂,可利太阳能热化学循环法分解H2O制H2,其物质转化如图所示。
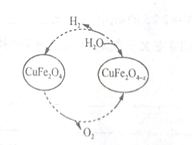
(4)氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为
(5)若x=0.15,则1mol CuFe2O4-x参与一次该循环,理论上能制得的H2体积为
相似题推荐
 的反应历程,该反应经历了I、II、III三个过渡态。图中显示的是反应路径中每一阶段内各驻点的能量相对于此阶段内反应物能量的差值。
的反应历程,该反应经历了I、II、III三个过渡态。图中显示的是反应路径中每一阶段内各驻点的能量相对于此阶段内反应物能量的差值。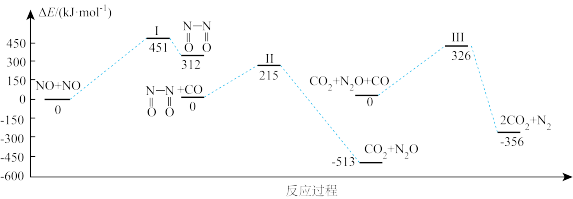
(1)由图象可知NO与CO总反应的热化学方程式
(2)若按
 的投料比将NO与CO充入VL的刚性恒容密闭容器中,在一定条件下发生(1)反应,正、逆反应速率可以表达为
的投料比将NO与CO充入VL的刚性恒容密闭容器中,在一定条件下发生(1)反应,正、逆反应速率可以表达为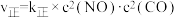 ,
,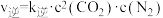 (
( 、
、 表示速率常数)测定CO的平衡转化率与温度、压强的关系如图甲所示。
表示速率常数)测定CO的平衡转化率与温度、压强的关系如图甲所示。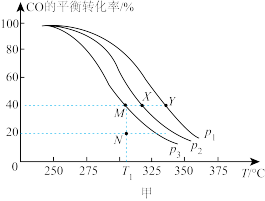
①压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②
 ℃,若向该容器中充入3.0molNO和3.0molCO发生上述反应,5min后反应达到平衡(M点),则0~5min内,
℃,若向该容器中充入3.0molNO和3.0molCO发生上述反应,5min后反应达到平衡(M点),则0~5min内,
 ,则N点的
,则N点的
③体系总压强(P)与时间(t)的关系如图乙中曲线I所示:曲线II为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同,曲线II所对应的改变的条件可能为
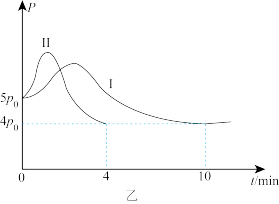
(3)在密闭容器中只发生历程II的反应,
 ,下列能说明反应已达平衡状态的有_______
,下列能说明反应已达平衡状态的有_______A.单位时间内生成 的同时消耗了1molCO 的同时消耗了1molCO |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒压的容器中,容器的体积不再变化 |
D.在恒温恒压的容器中,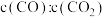 比值不变 比值不变 |
(1)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
②吸收液吸收SO2的过程中,pH随n(SO
 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
③当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
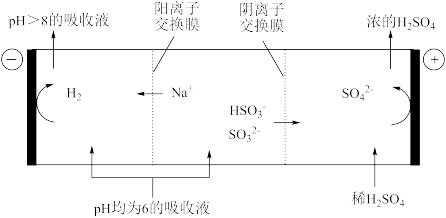
写出HSO
 在阳极放电的电极反应式:
在阳极放电的电极反应式:(2)用CH4催化还原NO2可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);ΔH=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g):ΔH=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g)+H2O(g)
 CO2(g)+H2(g):ΔH<0
CO2(g)+H2(g):ΔH<0—定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(1)的△H=
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0min | 10min | 20min | 30min | 40min | 50min | |
| O2(mol·L-1) | 1.00 | 0.79 | 0.60 | 0.60 | 0.75 | 0.75 |
| CO2(mol·L-1) | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
A.加入一定量的粉状碳酸钙
B.通入一定量的O2
C.适当缩小容器的体积
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)
 N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示: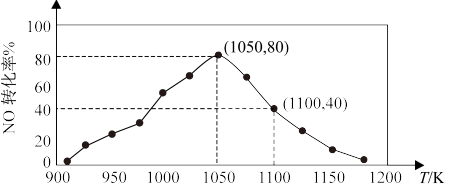
①在1100K时,CO2的体积分数为
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,与温度有关)。①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则

 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的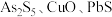 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: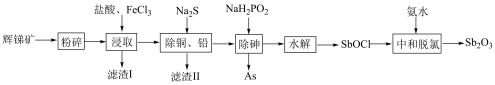
 ;
;②
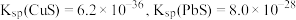 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
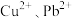 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时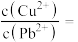
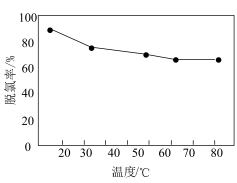
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
(6)锑可用于制备超亮光电极材料
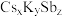 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为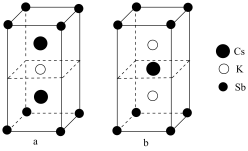
【推荐2】钛铁铳矿可有效富集回收矿石中铁、钛、钪金属,获得铁精矿、钛精矿、钪精矿等主产品。从钛铁钪矿(主要成分有Sc2O3、FeTiO3、SiO2等)中制备草酸铳晶[Sc2(C2O4)3•5H2O]流程如下:
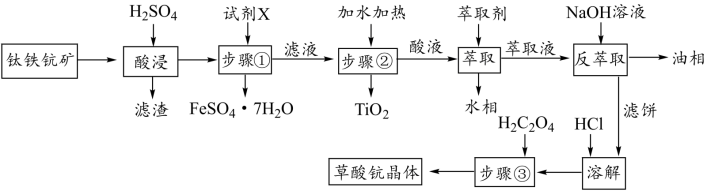
已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+xTBP Sc(HA2)3•xTBP+xH2O
Sc(HA2)3•xTBP+xH2O
②常温下Sc(OH)3的Ksp约为1.0×10-31
请回答下列问题:
(1)酸浸时为了提高酸浸速率,可采取的措施
(2)酸浸时“FeTiO3”溶解的离子方程式为
(3)步骤①的操作是浓缩、冷却、
(4)步骤②加大量的水稀释,同时加热的原因为
(5)“反萃取”的化学方程式为
(6)称取2.22g步骤③得到的草酸钪晶体[Sc2(C2O4)3•5H2O],在一定温度下加热得到0.69g固体,通过计算确定固体成分化学式为
(7)常温下,使0.1mol/LScCl3溶液中钪离子开始沉淀时的pH为
 、
、 、
、 ,还有少量
,还有少量 及
及 、
、 、
、 等杂质离子)制备三水磷酸氢镁工艺的流程如下:
等杂质离子)制备三水磷酸氢镁工艺的流程如下: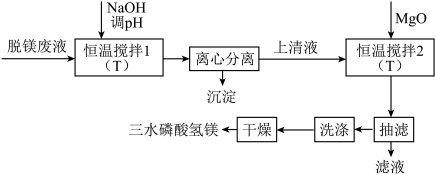
已知:T温度下,磷酸的pKa与溶液的pH的关系如下图。
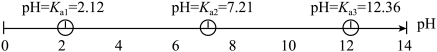
回答下列问题:
(1)“恒温搅拌1”步骤后溶液pH为4.5,溶液中
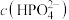
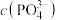 (填>、<或=),此时杂质
(填>、<或=),此时杂质 、
、 、
、 沉淀效果最好,
沉淀效果最好, 生成
生成 ,其余沉淀均是磷酸正盐,写出
,其余沉淀均是磷酸正盐,写出 与
与 反应生成沉淀的离子方程式
反应生成沉淀的离子方程式 的浓度为
的浓度为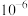 mol·L
mol·L ,则
,则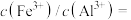

 ,
, )。
)。(2)“恒温搅拌2”中需添加MgO,其作用是
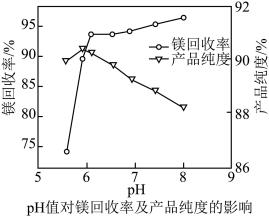
(3)从图像可以看出,pH对镁回收率及产品纯度的影响较大,pH>6.0时,随着pH的增加,产品的纯度降低,分析纯度降低的原因