为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将a/10g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:__________________________
 KMnO4+
KMnO4+ FeSO4+
FeSO4+ H2SO4===
H2SO4=== Fe2(SO4)3+
Fe2(SO4)3+ MnSO4+
MnSO4+ K2SO4+
K2SO4+ H2O
H2O
(2)在滴定实验中不能选择________ 式滴定管,理由是______________ ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________ 和________ ;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________ (填“准确”、“不准确”或“不一定准确”),理由是____________ ;
②方案二________ (填“准确”、“不准确”或“不一定准确”),理由是_____________ 。
方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将a/10g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
 KMnO4+
KMnO4+ FeSO4+
FeSO4+ H2SO4===
H2SO4=== Fe2(SO4)3+
Fe2(SO4)3+ MnSO4+
MnSO4+ K2SO4+
K2SO4+ H2O
H2O(2)在滴定实验中不能选择
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一
②方案二
更新时间:2018-12-24 15:08:59
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】I.氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A 和B。A 为铵盐,B 在标准状况下为气态。在此反应中,若每有1体积氨气参加反应,同时有0.75 体积氟气参加反应;若每有8.96L 氨气(标准状况)参加反应,同时生成0.3 mol A。
(1) 写出氨气和氟气反应的化学方程式_____________________________________________________ 。
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):
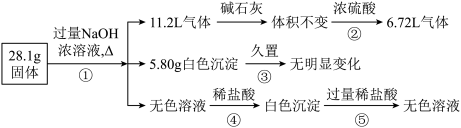
请回答下列问题:
(2)混合物中存在的物质有____________________ (填化学式)。
Ⅲ.(3)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41 g 硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6 g。则计算得x=____ (计算结果精确到0.1)。
Ⅳ.称取3.60 g草酸亚铁晶体(FeC2O4·2H2O),用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。
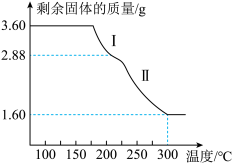
(4) 分析图中数据,写出过程Ⅰ发生反应的化学方程式______________ 。
(5) 300 ℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式______________________ 。
(1) 写出氨气和氟气反应的化学方程式
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):

请回答下列问题:
(2)混合物中存在的物质有
Ⅲ.(3)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41 g 硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6 g。则计算得x=
Ⅳ.称取3.60 g草酸亚铁晶体(FeC2O4·2H2O),用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。

(4) 分析图中数据,写出过程Ⅰ发生反应的化学方程式
(5) 300 ℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为__________ 。
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:__________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:
方案一:碱性条件下用 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为__________ 。
方案二:在碱性条件下,用铝粉处理,已知反应时Al与 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是__________ ,还原产物是__________ ,请写出反应的离子方程式:__________ 。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:
(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:方案一:碱性条件下用
 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为方案二:在碱性条件下,用铝粉处理,已知反应时Al与
 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3 大量地用于电镀工业中。
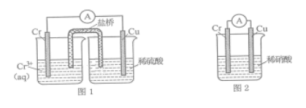
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体。根据上述现象试推测金属铬的两个重要化学性质___________ 、___________ 。
(2) CrO3 具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为___________ 。
(3) CrO3 的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
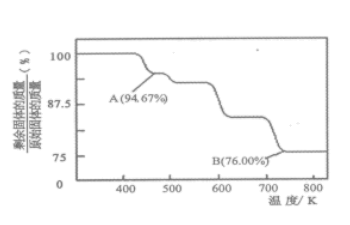
①A点时剩余固体的成分是___________ (填化学式)
②从开始加热到750K 时总反应方程式为___________ 。
(4) CrO3和K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。
①电解过程中NaCl的作用是___________ 。
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol·L-1,则溶液中c(Cr3+)为___________ mol·L-1。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体。根据上述现象试推测金属铬的两个重要化学性质

(2) CrO3 具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为
(3) CrO3 的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

①A点时剩余固体的成分是
②从开始加热到750K 时总反应方程式为
(4) CrO3和K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O
 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。①电解过程中NaCl的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol·L-1,则溶液中c(Cr3+)为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的的流程如下:
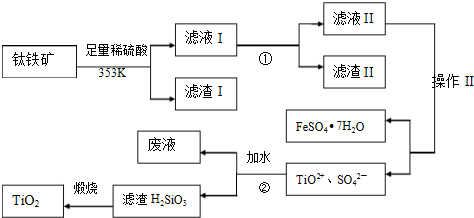
已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、____________________ (填离子符号);
(2)调节PH应最好使用_______________ ;
(3)操作II是指____________________________________ 洗涤、干燥。
(4)步骤②中发生的化学反应方程式为:___________________________________________ ;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入__________ 处理较合理。
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至___________________ ,记录消耗KMnO4溶液的体积为V mL;此时发生的反应为:
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为392),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%=________________________ 。

已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、
(2)调节PH应最好使用
| A.Fe | B.Ca(OH)2 | C.NH3•H2O | D.NaOH |
(3)操作II是指
(4)步骤②中发生的化学反应方程式为:
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为392),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1) 玻璃棒在中学化学实验中一般有如下三种用途:搅拌、引流和蘸取溶液。下列实验中至少用到其中两个用途的是_________ (填代号)。
①配制一定物质的量浓度的溶液 ②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④测定某溶液的pH
⑤从草木灰(主要成分碳酸钾)中提取钾盐 ⑥浓盐酸与浓氨水相遇发烟
(2)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由______________________________ 。
①配制一定物质的量浓度的溶液 ②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④测定某溶液的pH
⑤从草木灰(主要成分碳酸钾)中提取钾盐 ⑥浓盐酸与浓氨水相遇发烟
(2)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:___________ 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________ ,用硫代硫酸钠标准溶液继续滴定,________ ,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是___________ 。
(3)加入KI溶液后发生反应的离子方程式为____________ 。
(4)请补充完整实验步骤4中的内容:____________ ;____________ 。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2 mL盐酸(3mol∙L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mLKI溶液(100g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2=Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是
(3)加入KI溶液后发生反应的离子方程式为
(4)请补充完整实验步骤4中的内容:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1) 玻璃棒在中学化学实验中一般有如下三种用途:搅拌、引流和蘸取溶液。下列实验中至少用到其中两个用途的是_________ (填代号)。
①配制一定物质的量浓度的溶液 ②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④测定某溶液的pH
⑤从草木灰(主要成分碳酸钾)中提取钾盐 ⑥浓盐酸与浓氨水相遇发烟
(2)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由______________________________ 。
①配制一定物质的量浓度的溶液 ②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④测定某溶液的pH
⑤从草木灰(主要成分碳酸钾)中提取钾盐 ⑥浓盐酸与浓氨水相遇发烟
(2)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题:
(1)某学习小组研究1L某待测液,已知该待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或几种:
现进行如图实验操作(每次实验所加试剂均过量):

①由气体B可确定待测液中含有的离子是_______ 。
②由沉淀D和沉淀E可以判断待测液中一定含有的离子是________ 。
③由白色沉淀B可确定待测液中含有的离子是________ ,请写出溶液A反应生成沉淀B的离子方程式_______ 。
④综合分析,待测液中K+的最小浓度为________ 。
(2)该小组将26.3gNiSO4•nH2O样品在900℃下煅烧,样品受热过程的热重曲线(样品质量随温度变化的曲线)如图所示。

已知:L→N时失掉全部的结晶水。请回答下列问题。
①n的值是______ 。
②固体Q的化学式为_______ 。
(1)某学习小组研究1L某待测液,已知该待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或几种:
| 阳离子 | K+、NH 、Mg2+、Ba2+、Fe3+ 、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、Br-、CO 、HCO 、HCO 、SO 、SO |

①由气体B可确定待测液中含有的离子是
②由沉淀D和沉淀E可以判断待测液中一定含有的离子是
③由白色沉淀B可确定待测液中含有的离子是
④综合分析,待测液中K+的最小浓度为
(2)该小组将26.3gNiSO4•nH2O样品在900℃下煅烧,样品受热过程的热重曲线(样品质量随温度变化的曲线)如图所示。

已知:L→N时失掉全部的结晶水。请回答下列问题。
①n的值是
②固体Q的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】通过下列流程来制取少量亚硝酸钠(NaNO2),并进行纯度测定和性质实验:
已知:I.Na2CO3+NO+NO2=2NaNO2+CO2,Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___________ 。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___________ 。
(2)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00m L0.100mol•L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL 0.100mol•L-1 KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。
已知:NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2。
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___________ (“偏大”、“偏小”或“无影响”),原因是___________ 。
②通过计算,该样品中NaNO2的质量分数是___________ 。(写出计算过程)
(3)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体。该反应的离子方程式是___________ 。
已知:I.Na2CO3+NO+NO2=2NaNO2+CO2,Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是
(2)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00m L0.100mol•L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL 0.100mol•L-1 KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。
已知:NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2。
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度
②通过计算,该样品中NaNO2的质量分数是
(3)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体。该反应的离子方程式是
您最近一年使用:0次



