N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________ 。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________ 。
(3)NH3分子的立体构型为_________ ,中心原子的杂化类型是_________ 。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________ ,电负性最小的是_________ 。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________ 。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
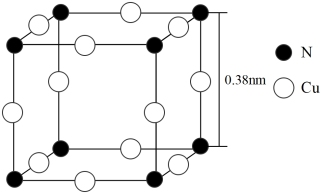
与每个Cu原子紧邻的Cu原子有_________ 个,阿伏伽德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
(1)基态铜原子的价电子排布式为
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是
(3)NH3分子的立体构型为
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为
(6)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有
更新时间:2019-01-05 07:35:26
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】短周期主族元素X、Y、Z、W、M、O的原子序数逐渐增大,其中部分元素的性质或原子结构如下表:
试回答下列问题:
(1)Y原子最外层电子的轨道表示式为_______ 。
(2)元素Y、Z的简单离子半径大小关系为_______ (填离子符号,用”>"连接)。
(3)X原子的第一电离能_______ Y原子(填“>”、“<”或“=”),理由是_______ 。
(4)下列状态的W的微粒中,电离最外层的一个电子所需能量最小的是_______(填序号)。
(5)元素M与元素O相比,非金属性较强的是_______ (填元素符号),下列表述中能证明这一事实的是_______ (填序号)。
a.常温下,M的单质与O的单质状态不同
b.简单氢化物的稳定性:M<O
c.一定条件下M和O的单质都能与氢氧化钠溶液反应
d.M的电负性为2.5,O的电负性为3.0
| 元素 | 元素性质或原子结构 |
| X | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 单质为银白色固体,质软,在空气中燃烧发出黄色的火焰 |
| W | 其最高价氧化物的水化物呈两性 |
| M | 原子序数是Y原子序数的2倍 |
试回答下列问题:
(1)Y原子最外层电子的轨道表示式为
(2)元素Y、Z的简单离子半径大小关系为
(3)X原子的第一电离能
(4)下列状态的W的微粒中,电离最外层的一个电子所需能量最小的是_______(填序号)。
| A.[Ne] | B.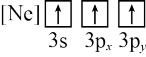 | C.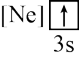 | D.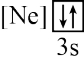 |
a.常温下,M的单质与O的单质状态不同
b.简单氢化物的稳定性:M<O
c.一定条件下M和O的单质都能与氢氧化钠溶液反应
d.M的电负性为2.5,O的电负性为3.0
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___ ;基态As原子的核外电子排布式为___ 。
(2)NH3的沸点比PH3的___ (填“高”或低”),原因是___ 。
(3)Na3AsO4中含有的化学键类型包括___ ,AsO43-的空间构型为___ 。
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加 德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___ ,该晶胞的密度为___ g·cm-3(用含NA、a的式子表示)。

(1)N、P、As的第一电离能由大到小的顺序为
(2)NH3的沸点比PH3的
(3)Na3AsO4中含有的化学键类型包括
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加 德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】镁合金的典型含量为大于90%的Mg、2~9%的Al、1~3%的Zn、0.2%的Mn,若熔进稀土金属(如镨、钍),可以大大提高镁合金在高温条件保持其强度的能力。Zn的熔点为419.5℃,Mg的熔点为650℃。回答下列问题:
(1)基态Mn原子的价电子排图(轨道表示式)为_______ 。
(2)Mg、Zn的晶体结构相同(如图a),下列叙述正确的是_______(填标号)。
(3)工业上均采用碳酸盐分解法制取氧化镁与生石灰,MgCO3的分解温度_______ (填“高于”或“低于”) CaCO3,原因是_______ 。
(4)人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。_______ ;写出两个与CO2互为等电子体的阴离子的化学式_______ 。
②碳酸酐酶的部分结构如图b所示,为Zn2+提供电子对形成配位键的原子有_______ 个,图b中碳原子的杂化类型为_______ 。
(5)一种锌镁合金的六方晶胞如图c所示,除棱心和顶角外,晶胞内还有六个 原子,所有的Mg均在晶胞内部。则合金密度为
原子,所有的Mg均在晶胞内部。则合金密度为_______ g▪ cm-3 (写出计算式即可,阿伏加德常数用NA表示)。
(1)基态Mn原子的价电子排图(轨道表示式)为
(2)Mg、Zn的晶体结构相同(如图a),下列叙述正确的是_______(填标号)。
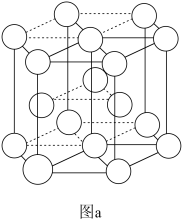
| A.金属键:Mg强于Zn | B.原子的配位数为8 |
| C.晶胞的空间利用率为68% | D.晶体中既存在四面体空隙又存在八面体空隙 |
(4)人体内碳酸酐酶可以使CO2水合和脱水反应速率分别加快13000和25000倍。
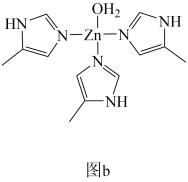
②碳酸酐酶的部分结构如图b所示,为Zn2+提供电子对形成配位键的原子有
(5)一种锌镁合金的六方晶胞如图c所示,除棱心和顶角外,晶胞内还有六个
 原子,所有的Mg均在晶胞内部。则合金密度为
原子,所有的Mg均在晶胞内部。则合金密度为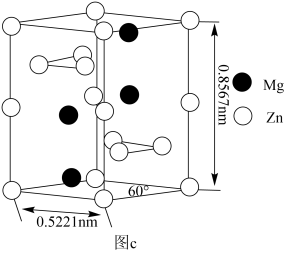
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为___ 。
(2)CuSO4和Cu(NO3)2是自然界中重要的铜盐, 的立体构型是
的立体构型是___ ,S、O、N三种元素的第一电离能由大到小为___ 。
(3)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___ ,反应的离子方程式为___ 。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO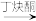 OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有
OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有___ 。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为___ ,它代表__ 原子。
②若Cu2O晶体密度为dg·cm-3,晶胞参数为apm,则阿伏加德罗常数值NA=___ 。
(1)Cu+的核外电子排布式为
(2)CuSO4和Cu(NO3)2是自然界中重要的铜盐,
 的立体构型是
的立体构型是(3)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO
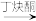 OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有
OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(
 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为②若Cu2O晶体密度为dg·cm-3,晶胞参数为apm,则阿伏加德罗常数值NA=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】已知A、B、C、D、E、F都是周期表前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。E3+的M层3d轨道电子为半满状态。F原子M能级为全充满状态,且核外的未成对电子只有一个。请回答下列问题:(答题要求:答题时用所对应的元素符号表示)
(1)F原子位于元素周期表的___ 区,基态E原子价层电子的轨道表示式为___ 。
(2)A、B、C的电负性由小到大的顺序为___ 。
(3)F和Mn(质子数为25)两元素的部分电离能数据如表:
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态F2+再失去一个电子难,理由是___ 。
(4)无水CrCl3和氨分子作用能形成某种配合物CrCl3•6NH3。若加入AgNO3溶液,能从该配合物的水溶液中将所有的Cl-沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生,写出该配合物的化学式___ (体现出其内界和外界);1mol该配合物中含有σ键的数目为___ 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如表所示:
H2S和H2C2的相对分子质量相同,造成上述物理性质差异的主要原因是___ 。
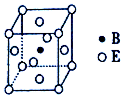
(6)B和E形成一种晶体,晶胞结构如图所示,则该晶体的化学式为___ ,若该晶体的密度为ρg•cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的体积是___ cm3。
(1)F原子位于元素周期表的
(2)A、B、C的电负性由小到大的顺序为
(3)F和Mn(质子数为25)两元素的部分电离能数据如表:
| 元素 | Mn | F | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态F2+再失去一个电子难,理由是
(4)无水CrCl3和氨分子作用能形成某种配合物CrCl3•6NH3。若加入AgNO3溶液,能从该配合物的水溶液中将所有的Cl-沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生,写出该配合物的化学式
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如表所示:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2S和H2C2的相对分子质量相同,造成上述物理性质差异的主要原因是
(6)B和E形成一种晶体,晶胞结构如图所示,则该晶体的化学式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】周期表前四周期的元素A、B、C、D、E、F,原子序数依次增大,A是周期表中原子半径最小的元素,B的基态原子中只有1个未成对电子,C基态原子中有7种不同运动状态的电子,D的最外层电子数是其所处周期数的3倍,E与D同主族,F的一价阳离子最外层有18个电子。回答下列问题:
(1)F在周期表中的位置是_____________
(2)A元素与其他元素形成的含氧酸中,酸根呈三角锥结构的酸是_________ ,该酸的中心原子的杂化方式为_________
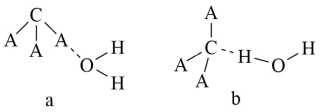
(3)CA3极易溶于水,试从下图中判断CA3溶于水后形成CA3·H2O的合理结构为_____ (填字母代号),推理依据是___________
(4)元素B可形成H3BO3,已知H3BO3的电离方程式为H3BO3+2 H2O⇌[B(OH)4]一+H3O+
①基态B、D原子的第一电离能由小到大的顺序为__________ (用元素符号表示)
②[B(OH)4]一中B原子的杂化类型为_______________
③写出一种与H3O+互为等电子体的分子的化学式:___________
④H3BO3晶体在热水中的溶解度大于冷水中的溶解度的原因为__________________
(1)F在周期表中的位置是
(2)A元素与其他元素形成的含氧酸中,酸根呈三角锥结构的酸是
(3)CA3极易溶于水,试从下图中判断CA3溶于水后形成CA3·H2O的合理结构为

(4)元素B可形成H3BO3,已知H3BO3的电离方程式为H3BO3+2 H2O⇌[B(OH)4]一+H3O+
①基态B、D原子的第一电离能由小到大的顺序为
②[B(OH)4]一中B原子的杂化类型为
③写出一种与H3O+互为等电子体的分子的化学式:
④H3BO3晶体在热水中的溶解度大于冷水中的溶解度的原因为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10.失去1个电子需要的能量由大到小排序是___________ (填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是___________ 。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl替代只得到1种结构,它的立体构型是___________ 。1 mol [Cd(NH3)4]2+含___________ mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为___________ 。
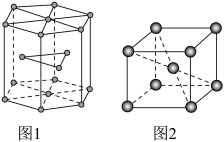
(5)锆晶胞如图1所示,1个晶胞含___________ 个Zr原子;这种堆积方式称为___________ 。
(6)镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm3.在该晶胞中两个镉原子最近核间距为___________ nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为___________ (用含π的代数式表示)。
(1)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10.失去1个电子需要的能量由大到小排序是
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl替代只得到1种结构,它的立体构型是
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为
(5)锆晶胞如图1所示,1个晶胞含
(6)镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm3.在该晶胞中两个镉原子最近核间距为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】下图是元素周期农中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的_______ 区。
(2)②、⑥两元素形成的化合物的空间构型为_______ ,其中心原子的杂化轨道类型为_______ 。
(3)③、④、⑤的电离能由大到小为_______ (填元素符号,下同),电负性由大到小为_______
(4)写出元素⑧基态原子的电子排布式_______ ;⑧的二价阳离子与过量的④的简单氢化物的水溶液作用生成深蓝色的配离子,该配离子的化学式为_______ 。
(5)元素⑨的氢氧化物不溶于水,但可溶于氨水中,该离子与 间结合的作用力为_______(填正确选项)。
间结合的作用力为_______(填正确选项)。
(6)元素⑦与 可形成的
可形成的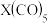 型化合物,该化合物常温下呈液态,熔点为
型化合物,该化合物常温下呈液态,熔点为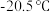 ,沸点为
,沸点为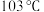 ,易溶于非极性溶剂,据此可判断该化合物晶体属于
,易溶于非极性溶剂,据此可判断该化合物晶体属于_______ 晶体(填晶体类型)。金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为_______ ,空间利用率较高的是_______ 堆积方式(填面心立方或体心立方),面心立方晶胞中原子的配位数是_______ 。


(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的
(2)②、⑥两元素形成的化合物的空间构型为
(3)③、④、⑤的电离能由大到小为
(4)写出元素⑧基态原子的电子排布式
(5)元素⑨的氢氧化物不溶于水,但可溶于氨水中,该离子与
 间结合的作用力为_______(填正确选项)。
间结合的作用力为_______(填正确选项)。| A.共价键 | B.离子键 | C.配位键 | D.分子间作用力 |
 可形成的
可形成的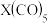 型化合物,该化合物常温下呈液态,熔点为
型化合物,该化合物常温下呈液态,熔点为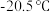 ,沸点为
,沸点为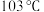 ,易溶于非极性溶剂,据此可判断该化合物晶体属于
,易溶于非极性溶剂,据此可判断该化合物晶体属于
您最近一年使用:0次
【推荐3】第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态Cu原子电子排布式为:__________ 。
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如:
①苯甲醇中碳原子的杂化类型是___________ 。
②苯甲醇的沸点比苯甲醛_______ 。(填“高”或“低”)
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是____________ 。
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强, 越大。分裂能(
越大。分裂能( )Co(H2O)62+
)Co(H2O)62+_______ Co(H2O)63+(填“ > ”“〈”或“ =”)。
(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是_________ 。

(5)Fe的一种晶体如图2所示,设阿伏加 德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为___ (只列出计算式)

(1)基态Cu原子电子排布式为:
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如:

①苯甲醇中碳原子的杂化类型是
②苯甲醇的沸点比苯甲醛
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用
 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强, 越大。分裂能(
越大。分裂能( )Co(H2O)62+
)Co(H2O)62+(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是

(5)Fe的一种晶体如图2所示,设阿伏加 德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________ ;B元素原子中的未成对电子数为_______________________ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______ ;A与B形成的AB2-的空间构型为___________________________ 。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________________ (用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________ ;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________ ;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________ 。
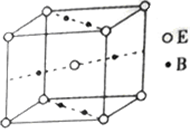
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为__________________________ 。
(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
(3)A、B、C三种元素的第一电离能从大到小的顺序为
(4)基态F3+的核外电子排布式是
(5)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮化硼具有优良的热稳定性、耐磨性及化学稳定性,可用作温度传感器,制造耐高温物件,如火箭的燃烧室内衬和等离子体喷射炉,制备氮化硼的流程图如图所示。

请回答下列问题:
(1)B的价层电子轨道表示式为____ 。
(2)H3BO3中元素的电负性由小到大的顺序是____ (填元素符号)。
(3)BF3分子的空间结构为____ 。
(4)下列关于上述流程涉及的部分物质说法正确的是____ (填标号)。
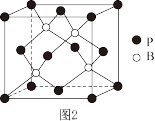
(5)某种功能陶瓷(化学式为BN),其原子在晶体结构中所处的位置如图1所示。每个B原子周围有____ 个等距离的N原子。

(6)磷化硼可用于光学吸收的研究及用作超硬的无机材料等,其立方晶胞结构如图2所示,从图中可知,B原子位于等距离P原子形成的____ (填空间结构)中心。

请回答下列问题:
(1)B的价层电子轨道表示式为
(2)H3BO3中元素的电负性由小到大的顺序是
(3)BF3分子的空间结构为
(4)下列关于上述流程涉及的部分物质说法正确的是
| A.H2SO4、H3BO3、NH3都是分子晶体 |
| B.BN的熔点高达3000℃,属于共价晶体 |
| C.BF3分子中所有原子都满足8电子稳定结构 |
| D.NH3和BF3都是AB3型化合物,因此它们都是极性分子 |

(6)磷化硼可用于光学吸收的研究及用作超硬的无机材料等,其立方晶胞结构如图2所示,从图中可知,B原子位于等距离P原子形成的

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;B、C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)单质A有两种同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ,A和B的氢化物所属的晶体类型分别为_______ 和_______ 。
(2)C和D反应可生成组成比为1∶3的化合物E,E的空间结构为_______ ,中心原子的杂化轨道类型为_______ 。
(3)单质D与湿润的碳酸钠反应可制备D2A,其化学方程式为_______ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566 nm,F的化学式为_______ ,晶体F的密度为_______ g·cm-3(结果保留两位小数)。
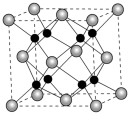
(1)单质A有两种同素异形体,其中沸点高的是
(2)C和D反应可生成组成比为1∶3的化合物E,E的空间结构为
(3)单质D与湿润的碳酸钠反应可制备D2A,其化学方程式为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566 nm,F的化学式为

您最近一年使用:0次



