实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4)的一种流程如下:
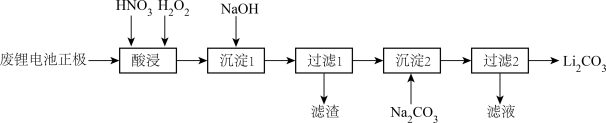
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_______________________________________________________ 。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________ 。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是___________ 。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________ 。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________ 。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________ 。
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________ ;HClO氧化除去氨氮的反应离子方程式是_________________________________ 。

(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是
更新时间:2019-02-20 13:37:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】2019年12月4日“全球碳计划”发布报告说,全球 排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。
排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。
(1)以 与
与 为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ: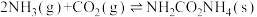
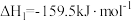 ;
;
反应Ⅱ: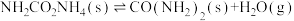
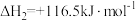 ;
;
反应Ⅲ:
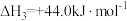 。
。
则反应Ⅳ: 与
与 合成尿素同时生成液态水的热化学方程式为
合成尿素同时生成液态水的热化学方程式为___________ 。
(2)利用工业废气中的 可以制取甲醇和水蒸气,其反应原理:
可以制取甲醇和水蒸气,其反应原理:
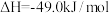 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生反应测得
,一定条件下发生反应测得 和
和 的浓度随时间变化如图所示,反应10min达到平衡。
的浓度随时间变化如图所示,反应10min达到平衡。
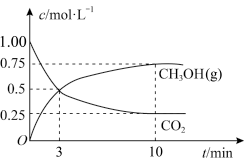
①从反应开始到平衡,氢气的平均反应速率
___________ 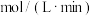 ;该反应的平衡常数为
;该反应的平衡常数为___________ (保留两位有效数字)。
②反应进行到3min时,v(正)___________ v(逆)(填“>”“<”或“=”)。
③下列措施可提高 转化率的是
转化率的是___________ 。
A.升高温度 B.将 从体系中分离出去
从体系中分离出去
C.恒容条件下充入He D.再充入适量的
(3)中国科学家首次用 高效合成乙酸,其反应路径如图所示:
高效合成乙酸,其反应路径如图所示:
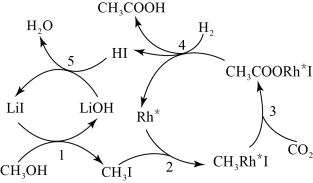
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:___________ 。
②根据图示,写出总反应的化学方程式:___________ 。
 排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。
排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。(1)以
 与
与 为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:反应Ⅰ:
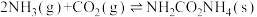
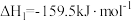 ;
;反应Ⅱ:
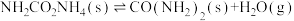
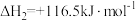 ;
;反应Ⅲ:

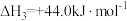 。
。则反应Ⅳ:
 与
与 合成尿素同时生成液态水的热化学方程式为
合成尿素同时生成液态水的热化学方程式为(2)利用工业废气中的
 可以制取甲醇和水蒸气,其反应原理:
可以制取甲醇和水蒸气,其反应原理:
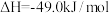 。在体积为1L的恒容密闭容器中,充入
。在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生反应测得
,一定条件下发生反应测得 和
和 的浓度随时间变化如图所示,反应10min达到平衡。
的浓度随时间变化如图所示,反应10min达到平衡。
①从反应开始到平衡,氢气的平均反应速率

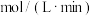 ;该反应的平衡常数为
;该反应的平衡常数为②反应进行到3min时,v(正)
③下列措施可提高
 转化率的是
转化率的是A.升高温度 B.将
 从体系中分离出去
从体系中分离出去C.恒容条件下充入He D.再充入适量的

(3)中国科学家首次用
 高效合成乙酸,其反应路径如图所示:
高效合成乙酸,其反应路径如图所示: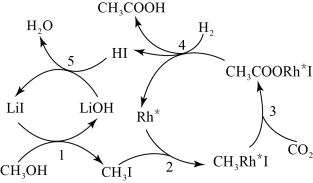
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②根据图示,写出总反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】次磷酸钠(NaH2PO2)广泛应用于电镀、材料等行业,在生产 NaH2PO2 的过程中会产生大量废渣[主要含 NaH2PO2和 CaHPO3,还含有少量 Ca(OH)2], 一种回收 NaH2PO2实现废渣资源化利用的工艺流程如图:
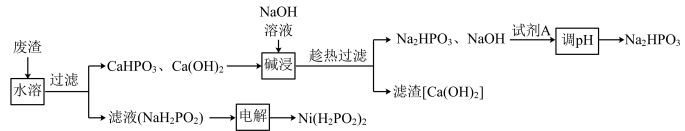
已知:CaHPO3和 Ca(OH)2的 Ksp 分别为 1 ×10-4和 6 ×10-6,H3PO3为二元中强酸。
回答下列问题:
(1)“碱浸”发生反应的化学方程式为__________ 。
(2)“试剂 A”的化学式为_________ 。
(3)电解 NaH2PO2溶液可制得 Ni(H2PO2)2,后者广泛用于化学镀镍,电解 NaH2PO2 溶液装置如图所示。阴极的电极反应式为__________ ,产品室能得到Ni(H2PO2)2的原理是_________ 。
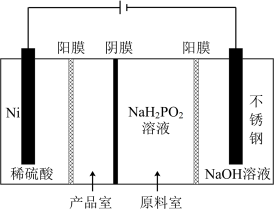
(4)化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成 ),发生反应的离子方程式为
),发生反应的离子方程式为________ 。

已知:CaHPO3和 Ca(OH)2的 Ksp 分别为 1 ×10-4和 6 ×10-6,H3PO3为二元中强酸。
回答下列问题:
(1)“碱浸”发生反应的化学方程式为
(2)“试剂 A”的化学式为
(3)电解 NaH2PO2溶液可制得 Ni(H2PO2)2,后者广泛用于化学镀镍,电解 NaH2PO2 溶液装置如图所示。阴极的电极反应式为

(4)化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成
 ),发生反应的离子方程式为
),发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
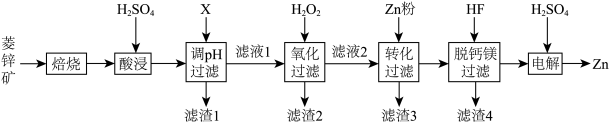
相关难溶物溶度积常数如下表:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L−1。
(4)H2O2是常见的氧化剂,其电子式为___________ , “氧化过滤”时H2O2需稍多加,其原因是_______ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
(6)“电解”装置示意如图。

开始通电时,阳极表面形成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。

相关难溶物溶度积常数如下表:
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10−39 | 1.3× 10−17 | 5.2×10−11 | 3.9×10−9 |
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3的离子方程式为
(4)H2O2是常见的氧化剂,其电子式为
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图。

开始通电时,阳极表面形成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近一年使用:0次
【推荐1】氯化亚铜(CuCl)是一种应用广泛的催化剂。工业上用低品铜矿(主要含CuS、FeO)制备CuCl的一种工艺流程如图:
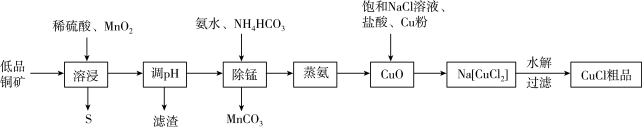
已知:
①氯化亚铜是一种不溶于乙醇,微溶于水的白色晶体,在潮湿空气中易水解、易被氧化。
②几种常见阳离子沉淀的pH如表。
回答下列问题:
(1)“溶浸”中MnO2的作用是________ 。
(2)调节pH时应控制的范围是________ ,可以选用的物质是________ 。
A.H2O2 B.CuO C.CuSO4 D.Cu(OH)2
(3)写出生成Na[CuCl2]的化学方程式________ 。
(4)制备CuCl粗品的过程中应隔绝空气,可能的原因是________ 。
(5)称取0.250gCuCl粗品置于预先放入若干玻璃珠和过量FeCl3溶液的锥形瓶中,不断摇动,待粗品完全溶解后,滴加2滴邻菲啰啉指示剂,立即用0.l00mol•L-1硫酸高铈[Ce(SO4)2]标准溶液滴定至终点,消耗标准溶液24.50mL。
相关反应为:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
通过计算可知,该粗品中CuCl的纯度为________ (保留小数点后一位)。

已知:
①氯化亚铜是一种不溶于乙醇,微溶于水的白色晶体,在潮湿空气中易水解、易被氧化。
②几种常见阳离子沉淀的pH如表。
| 阳离子 | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 1.9 | 4.7 | 8.1 |
| 完全沉淀 | 3.2 | 6.7 | 10.1 |
回答下列问题:
(1)“溶浸”中MnO2的作用是
(2)调节pH时应控制的范围是
A.H2O2 B.CuO C.CuSO4 D.Cu(OH)2
(3)写出生成Na[CuCl2]的化学方程式
(4)制备CuCl粗品的过程中应隔绝空气,可能的原因是
(5)称取0.250gCuCl粗品置于预先放入若干玻璃珠和过量FeCl3溶液的锥形瓶中,不断摇动,待粗品完全溶解后,滴加2滴邻菲啰啉指示剂,立即用0.l00mol•L-1硫酸高铈[Ce(SO4)2]标准溶液滴定至终点,消耗标准溶液24.50mL。
相关反应为:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
通过计算可知,该粗品中CuCl的纯度为
您最近一年使用:0次
【推荐2】以明矾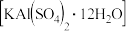 为原料制备Al、
为原料制备Al、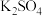 和
和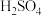 的工艺流程如下:
的工艺流程如下:
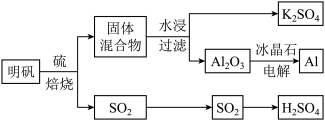
依据上述流程图回答下列问题:
 写出明矾和硫单质混合焙烧发生反应的化学方程式
写出明矾和硫单质混合焙烧发生反应的化学方程式______ .
 从水浸后的滤液中得到
从水浸后的滤液中得到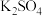 晶体的方法是蒸发浓缩、
晶体的方法是蒸发浓缩、______ 、过滤,实验室在蒸发浓缩过程中用到的主要仪器有______ .
 电解
电解 时加入冰晶石的作用是
时加入冰晶石的作用是______ .
 以Al和
以Al和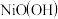 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时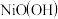 转化为
转化为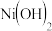 ,该电池反应的化学方程式是
,该电池反应的化学方程式是______ .
 焙烧产生的
焙烧产生的 可用于制硫酸.已知
可用于制硫酸.已知 ,101kPa时:
,101kPa时:
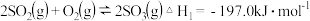

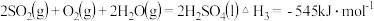
则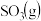 和
和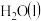 反应的热化学方程式是
反应的热化学方程式是______ .
 焙烧948吨明矾
焙烧948吨明矾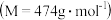 ,若
,若 的利用率为
的利用率为 ,则可生产多少吨质量分数为
,则可生产多少吨质量分数为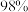 的硫酸?
的硫酸?
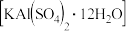 为原料制备Al、
为原料制备Al、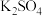 和
和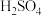 的工艺流程如下:
的工艺流程如下:
依据上述流程图回答下列问题:
 写出明矾和硫单质混合焙烧发生反应的化学方程式
写出明矾和硫单质混合焙烧发生反应的化学方程式 从水浸后的滤液中得到
从水浸后的滤液中得到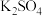 晶体的方法是蒸发浓缩、
晶体的方法是蒸发浓缩、 电解
电解 时加入冰晶石的作用是
时加入冰晶石的作用是 以Al和
以Al和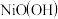 为电极,NaOH溶液为电解液组成一种新型电池,放电时
为电极,NaOH溶液为电解液组成一种新型电池,放电时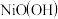 转化为
转化为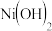 ,该电池反应的化学方程式是
,该电池反应的化学方程式是 焙烧产生的
焙烧产生的 可用于制硫酸.已知
可用于制硫酸.已知 ,101kPa时:
,101kPa时: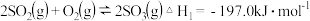

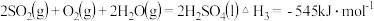
则
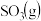 和
和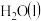 反应的热化学方程式是
反应的热化学方程式是 焙烧948吨明矾
焙烧948吨明矾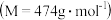 ,若
,若 的利用率为
的利用率为 ,则可生产多少吨质量分数为
,则可生产多少吨质量分数为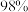 的硫酸?
的硫酸?
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】钒是重要的化学催化剂,从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题:
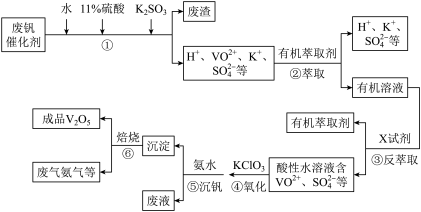
(1)步骤①中废渣的主要成分是____________ ,K2SO3的作用是_________________________ 。
(2)操作②中用到的主要玻璃仪器是____________________ 。
(3)②、③的变化过程可简化为(下式R表示VO2+或Fe3+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是____________________________________ 。
(4)请完成④中的反应离子方程式:
_____ ClO3- + VO2+ + H+ = VO3+ + +
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为____________ 。若矾沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<___________ 。(已知:25℃时,Ksp Fe(OH)3=2.6×10-39)
(6)该工艺流程中,可以循环利用的物质有________________________ 。

(1)步骤①中废渣的主要成分是
(2)操作②中用到的主要玻璃仪器是
(3)②、③的变化过程可简化为(下式R表示VO2+或Fe3+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层)
 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是(4)请完成④中的反应离子方程式:
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(6)该工艺流程中,可以循环利用的物质有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】高铁酸钾 是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图所示:
是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图所示:
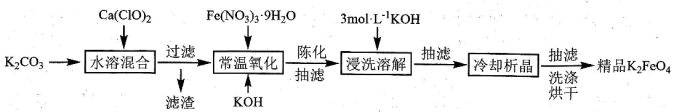
已知高铁酸盐热稳定性差,在碱性环境中比酸性环境中相对稳定。回答以下问题:
(1)高铁酸钾 中氧元素在元素周期表中属于
中氧元素在元素周期表中属于___________ 区元素, 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
(2)写出氧化过程的离子方程式___________ 。
(3)氧化时控温20~25℃,温度不能高于25℃原因是___________ 。
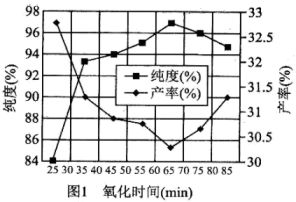
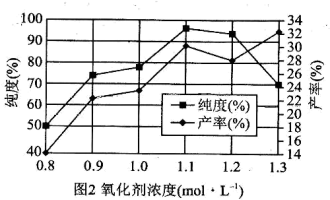
(4)实验测得氧化时间、氧化剂浓度与 产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间应控制在
产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间应控制在___________  ,氧化剂浓度应控制在
,氧化剂浓度应控制在___________  。
。
(5)某工业废水含 (浓度为
(浓度为 ),可用高铁酸钾氧化混凝去除。为避免形成
),可用高铁酸钾氧化混凝去除。为避免形成 降低去除率,控制体系
降低去除率,控制体系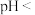
___________ (常温下 )。
)。
 是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图所示:
是一种多功能的新型水处理剂。一种湿法制备高铁酸钾的新工艺流程如图所示:
已知高铁酸盐热稳定性差,在碱性环境中比酸性环境中相对稳定。回答以下问题:
(1)高铁酸钾
 中氧元素在元素周期表中属于
中氧元素在元素周期表中属于 原子的核外电子排布式为
原子的核外电子排布式为(2)写出氧化过程的离子方程式
(3)氧化时控温20~25℃,温度不能高于25℃原因是
(4)实验测得氧化时间、氧化剂浓度与
 产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间应控制在
产率、纯度的实验数据分别如图1、图2所示。为了获取更纯的高铁酸钾,反应时间应控制在 ,氧化剂浓度应控制在
,氧化剂浓度应控制在 。
。

(5)某工业废水含
 (浓度为
(浓度为 ),可用高铁酸钾氧化混凝去除。为避免形成
),可用高铁酸钾氧化混凝去除。为避免形成 降低去除率,控制体系
降低去除率,控制体系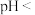
 )。
)。
您最近一年使用:0次
【推荐2】硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:2SO2(g)+O2(g)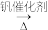 2SO3(g) ΔH=-196 kJ·mol-1。回答下列问题:
2SO3(g) ΔH=-196 kJ·mol-1。回答下列问题:
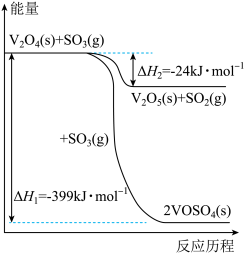
(1) 钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:__________________________ 。
(2) 工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
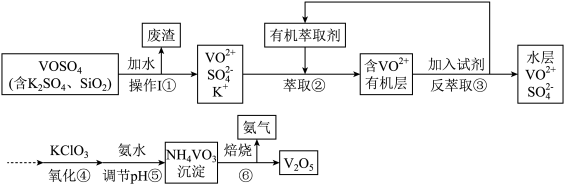
请回答下列问题:
①步骤①所得废渣的成分是__________ (写化学式),操作I的名称______________ 。
②步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层)
2RAn(有机层)+n H2SO4(水层)
②中萃取时必须加入适量碱,其原因是_________________________________ 。
③中X试剂为(写化学式)________________ 。
③④的离子方程式为_____________________________________ 。
 2SO3(g) ΔH=-196 kJ·mol-1。回答下列问题:
2SO3(g) ΔH=-196 kJ·mol-1。回答下列问题:(1) 钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:

(2) 工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
①步骤①所得废渣的成分是
②步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2n HA(有机层)
 2RAn(有机层)+n H2SO4(水层)
2RAn(有机层)+n H2SO4(水层)②中萃取时必须加入适量碱,其原因是
③中X试剂为(写化学式)
③④的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
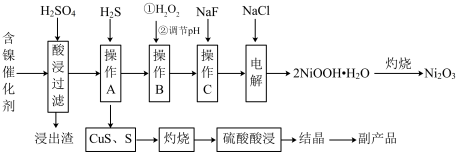
【推荐3】【加试题】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,常用于制作重要的电子元件材料和蓄电池材料。某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料生产2NiOOH•H2O沉淀,继而制备Ni2O3。实验工艺流程为:
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
②常温下CaF2难溶于水,微溶于无机酸
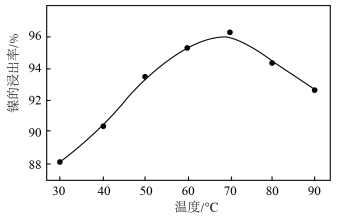
(1)操作B中需调节pH范围为____ ,使用Na2CO3调节pH过程中发生的反应有___ 。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因____ 。
(2)下列说法正确的是____
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO4•2H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式_____ 。
(4)操作C加入NaF后如何证明沉淀完全____ 。
(5)工业上也可通过将草酸镍(NiC2O4•2H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为____ 。

已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.6 | 9.7 | 9.2 |
(1)操作B中需调节pH范围为

(2)下列说法正确的是
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO4•2H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式
(4)操作C加入NaF后如何证明沉淀完全
(5)工业上也可通过将草酸镍(NiC2O4•2H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为
您最近一年使用:0次



