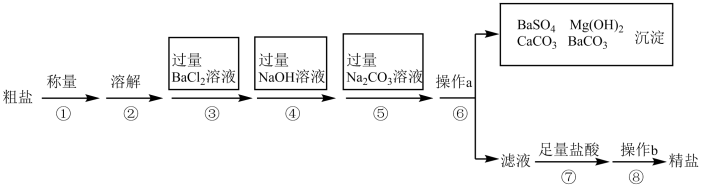
实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______ ;所加H2SO4不宜过量太多的原因是_______ 。
(2)加入H2O2氧化时发生发应的离子方程式为___________ 。
(3)用图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
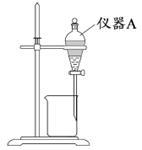
①实验装置图中仪器A的名称为_______ 。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______ 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______ ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是
(2)加入H2O2氧化时发生发应的离子方程式为
(3)用图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
更新时间:2020-09-13 21:01:38
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某Al2O3样品中含有一定量的Cu、Fe,以及少量的Fe2O3。现通过下列生产过程,从该样品中回收铁红。流程如图:
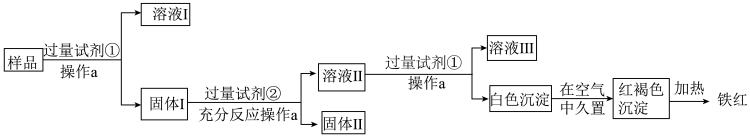
(1)操作a需要的玻璃仪器有烧杯、漏斗、____ 。
(2)溶液Ⅰ中除OH-外还含有大量的阴离子是____ 。
(3)试剂②是____ ,加入试剂②后发生的化学方程式为____ 。
(4)白色沉淀的成分是____ ;写出白色沉淀转化为红褐色沉淀的化学方程式:____ 。
(5)溶液Ⅱ中铁元素的存在形式是____ (填离子符号),如何用实验证明:____ 。

(1)操作a需要的玻璃仪器有烧杯、漏斗、
(2)溶液Ⅰ中除OH-外还含有大量的阴离子是
(3)试剂②是
(4)白色沉淀的成分是
(5)溶液Ⅱ中铁元素的存在形式是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】铝及其化合物在生产、生活中有重要应用。以某废料(主要成分为Na2SiF6,其他杂质忽略不计)为原料制备冰晶石(Na3AlF6)的一种流程如图所示:

已知:Na2SiF6+4NH3·H2O=2NaF+4NH4F+X↓+2H2O
(1)滤渣X是_________ (写化学式)。
(2)写出“水浴加热”过程中发生反应的化学方程式:_________ 。
(3)制备冰晶石的另一种方法:用氢氧化铝、碳酸钠溶液的混合物吸收HF,放出气体CO2。理论上,反应物Al(OH)3、Na2CO3、HF的物质的量之比为____________ 。
(4)以铝土矿(主要成分为Al2O3,含有杂质Fe2O3、MgO、SiO2)为原料制备NaAlO2、AlCl3。
①参照上述流程,以铝土矿为原料制备NaAlO2溶液。
设计方案流程图:_______ 。(供选试剂:NaOH溶液、稀盐酸、CO2、氨水、铝土矿)
②已知:几种金属氢氧化物沉淀的pH如表所示。
注:pH≥11.2时,Al(OH)3开始溶解。
利用铝土矿制备氯化铝过程中,要用NaOH溶液调节pH,从含Fe3+、Al3+、Mg2+的溶液中分离出Al(OH)3,先调节pH为3.2,过滤;在滤液中加入氢氧化钠溶液,调节pH范围为____ ,过滤、洗涤、干燥得氢氧化铝。 当pH=5时,溶液中c(Al3+)为___ mol·L-1。[已知:常温下,Al(OH)3的Ksp=2.0×10-34]
(5)NaAlH4在有机合成中作还原剂,可由AlCl3和NaH在一定条件下合成。NaAlH4的有效氢为__ 。(用分数表示)(已知:有效氢指1 g含氢还原剂的还原能力相当于多少克H2的还原能力。NaAlH4在氧化还原反应中氢元素的化合价升高至+1)

已知:Na2SiF6+4NH3·H2O=2NaF+4NH4F+X↓+2H2O
(1)滤渣X是
(2)写出“水浴加热”过程中发生反应的化学方程式:
(3)制备冰晶石的另一种方法:用氢氧化铝、碳酸钠溶液的混合物吸收HF,放出气体CO2。理论上,反应物Al(OH)3、Na2CO3、HF的物质的量之比为
(4)以铝土矿(主要成分为Al2O3,含有杂质Fe2O3、MgO、SiO2)为原料制备NaAlO2、AlCl3。
①参照上述流程,以铝土矿为原料制备NaAlO2溶液。
设计方案流程图:
②已知:几种金属氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.1 |
| 完全沉淀pH | 3.1 | 4.0 | 11.1 |
利用铝土矿制备氯化铝过程中,要用NaOH溶液调节pH,从含Fe3+、Al3+、Mg2+的溶液中分离出Al(OH)3,先调节pH为3.2,过滤;在滤液中加入氢氧化钠溶液,调节pH范围为
(5)NaAlH4在有机合成中作还原剂,可由AlCl3和NaH在一定条件下合成。NaAlH4的有效氢为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】工业上以铝土矿(主要成分为 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氧化铝,流程如下:
等杂质)为主要原料制备氧化铝,流程如下:
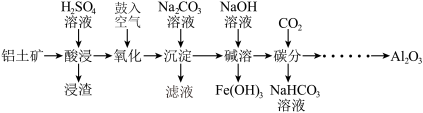
(1)酸浸:
①为提高铝土矿的酸浸率,通常可采用的方法有_______ (写出两种即可)。
②浸渣的主要成分为_______ (填化学式)。
(2)氧化:用 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ ,为证明 已完全被氧化为
已完全被氧化为 ,所需的试剂为
,所需的试剂为_______ 。
(3)沉淀:用 溶液调节pH,将
溶液调节pH,将 、
、 转化为氢氧化物沉淀,溶液终点pH对铝、铁沉淀率的影响如图所示。
转化为氢氧化物沉淀,溶液终点pH对铝、铁沉淀率的影响如图所示。
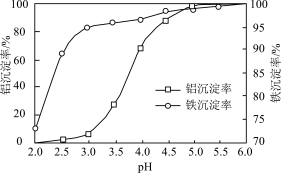
为获得较高的铝、铁沉淀率,应控制溶液pH最佳为________ 左右,其理由是_______ 。
(4)碱溶:用 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式_______ ,分离出 的实验操作
的实验操作_______ (填名称)。
(5)碳分:向碱溶后的溶液中通入过量 气体,该反应的离子方程式为
气体,该反应的离子方程式为________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为主要原料制备氧化铝,流程如下:
等杂质)为主要原料制备氧化铝,流程如下:
(1)酸浸:
①为提高铝土矿的酸浸率,通常可采用的方法有
②浸渣的主要成分为
(2)氧化:用
 将
将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为 已完全被氧化为
已完全被氧化为 ,所需的试剂为
,所需的试剂为(3)沉淀:用
 溶液调节pH,将
溶液调节pH,将 、
、 转化为氢氧化物沉淀,溶液终点pH对铝、铁沉淀率的影响如图所示。
转化为氢氧化物沉淀,溶液终点pH对铝、铁沉淀率的影响如图所示。
为获得较高的铝、铁沉淀率,应控制溶液pH最佳为
(4)碱溶:用
 溶液溶解沉淀,写出发生反应的离子方程式
溶液溶解沉淀,写出发生反应的离子方程式 的实验操作
的实验操作(5)碳分:向碱溶后的溶液中通入过量
 气体,该反应的离子方程式为
气体,该反应的离子方程式为
您最近半年使用:0次
【推荐1】钪( )是一种功能强大的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁
)是一种功能强大的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁 ,还含有少量
,还含有少量 、
、 、
、 等杂质,从钛铁矿中提取
等杂质,从钛铁矿中提取 的流程如下图:
的流程如下图:
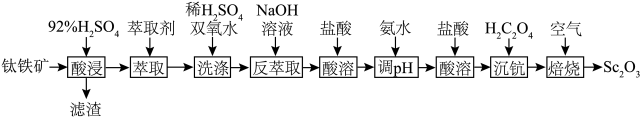
回答下列问题:
(1)“滤渣”的主要成分是
(2)“酸浸”后,钛主要以
 的形式存在于溶液中,
的形式存在于溶液中, 在一定条件下可完全水解生成
在一定条件下可完全水解生成 ,写出
,写出 水解的离子方程式:
水解的离子方程式:(3)实验室萃取装置如下图所示,仪器a的名称为
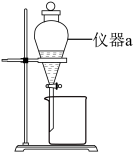
(4)25℃时“调
 ”先加氨水调节
”先加氨水调节 ,过滤除去
,过滤除去 。再向滤液中加入氨水调节
。再向滤液中加入氨水调节 ,已知
,已知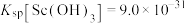 ,此时滤液中
,此时滤液中 的浓度为
的浓度为 。写出检验含
。写出检验含 滤液中是否含
滤液中是否含 的方法:
的方法:(5)“沉钪”时用到草酸,已知草酸的
 ;
;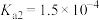 ,则在25℃时,
,则在25℃时, 的草酸溶液中
的草酸溶液中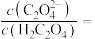
(6)
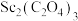 在空气中“焙烧”时生成
在空气中“焙烧”时生成 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】明矾[KAl(SO4)2•12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料—铝灰(含 Al、Al2O3及少量 SiO2和 FeO•xFe2O3)可制备明矾。工艺流程如下:
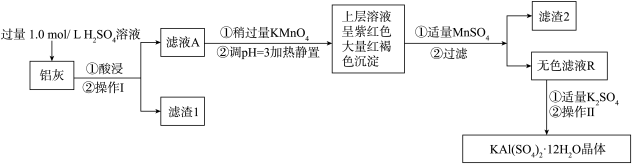
回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4溶液,需要 18 mol / L H2SO4溶液的体积是__ ,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 ______ 。
(2)明矾净水的原理是________ (用离子方程式表示)。
(3)检验滤液 A 中是否存在 Fe2+的实验操作是________ 。
(4)在滤液 A 中加入高锰酸钾溶液的目的是______ (用离子方程式表示)(该条件下 MnO4-转化为 Mn2+)
(5)已知:加入 MnSO4,Mn2+可与 MnO4-反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为____ 。
(6)操作Ⅱ是_____ 、______ 、过滤、洗涤、干燥。

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4溶液,需要 18 mol / L H2SO4溶液的体积是
(2)明矾净水的原理是
(3)检验滤液 A 中是否存在 Fe2+的实验操作是
(4)在滤液 A 中加入高锰酸钾溶液的目的是
(5)已知:加入 MnSO4,Mn2+可与 MnO4-反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为
(6)操作Ⅱ是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】碘在工农业生产和日常生活中有重要用途。

(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是______________ (从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
步骤④发生反应的离子方程式为__________________________________ 。若步骤⑤采用四氯化碳来提取碘,将四氯化碳加入含碘水溶液并振荡,将观察到的现象是____________________ 。操作⑥可用的方法是:_________________ 。
A、加碱洗涤法 B、过滤法 C、萃取分液法 D、蒸馏或分馏法
(2)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟
水反应的方程式为:IBr+H2O=HBr+HIO等,下列有关IBr的叙述中错误的是:_______ 。
A.跟溴、碘相似,固体溴化碘熔沸点也很低
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(3)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)形式存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,请写出反应的离子方程式:__________________________ 。

(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
步骤④发生反应的离子方程式为
A、加碱洗涤法 B、过滤法 C、萃取分液法 D、蒸馏或分馏法
(2)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟
水反应的方程式为:IBr+H2O=HBr+HIO等,下列有关IBr的叙述中错误的是:
A.跟溴、碘相似,固体溴化碘熔沸点也很低
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(3)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)形式存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,请写出反应的离子方程式:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】ZnO是一种难溶于水的白色固体,在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上由菱锌矿(主要成分为 、ZnO,还含有少量
、ZnO,还含有少量 、FeO、
、FeO、 、
、 等杂质)制备ZnO的工艺流程如图所示:
等杂质)制备ZnO的工艺流程如图所示: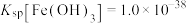 ,
,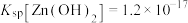 ;
;
②“溶浸”后的溶液所含金属离子主要有: 、
、 、
、 、
、 ;
;
③氧化性顺序: 。
。
回答下列问题:
(1)基态Zn原子的最高能层符号为__________ 。
(2)滤渣1的化学式是__________ ,“溶浸”过程中 发生反应的离子方程式是
发生反应的离子方程式是__________ 。
(3)“氧化”时适当加热,其目的是__________ ,但温度不能过高,其原因是__________ 。
(4)已知“氧化”后溶液中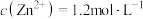 ,“调pH”的pH范围是
,“调pH”的pH范围是__________ (保留两位有效数字)。(已知:溶液中离子浓度小于等于 时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是
时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是__________ 。
(5)有机萃取剂HA与 反应的化学方程式为
反应的化学方程式为 ,则“反萃取”时加入试剂X的化学式是
,则“反萃取”时加入试剂X的化学式是__________ 。
(6)在“沉锌”与“灼烧”之间进行的操作是__________ ,“沉锌”得到碱式碳酸锌[化学式为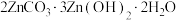 ],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是
],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是__________ (填化学式)。
 、ZnO,还含有少量
、ZnO,还含有少量 、FeO、
、FeO、 、
、 等杂质)制备ZnO的工艺流程如图所示:
等杂质)制备ZnO的工艺流程如图所示: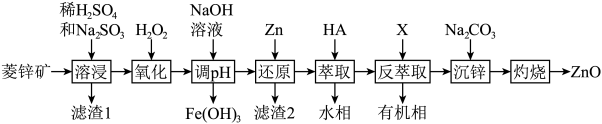
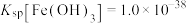 ,
,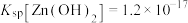 ;
;②“溶浸”后的溶液所含金属离子主要有:
 、
、 、
、 、
、 ;
;③氧化性顺序:
 。
。回答下列问题:
(1)基态Zn原子的最高能层符号为
(2)滤渣1的化学式是
 发生反应的离子方程式是
发生反应的离子方程式是(3)“氧化”时适当加热,其目的是
(4)已知“氧化”后溶液中
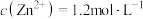 ,“调pH”的pH范围是
,“调pH”的pH范围是 时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是
时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是(5)有机萃取剂HA与
 反应的化学方程式为
反应的化学方程式为 ,则“反萃取”时加入试剂X的化学式是
,则“反萃取”时加入试剂X的化学式是(6)在“沉锌”与“灼烧”之间进行的操作是
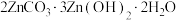 ],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是
],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是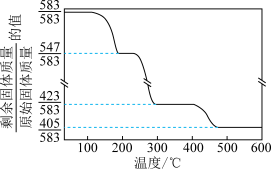
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。人们在化工实践中,以富钒炉渣(其中的钒以 、
、 等形式存在,还有少量的
等形式存在,还有少量的 、
、 等)为原料提取金属钒的工艺流程如图所示。
等)为原料提取金属钒的工艺流程如图所示。

提示:①钒有多种价态,其中+5价最稳定;
② 在碱性条件下可转化为
在碱性条件下可转化为 。
。
(1)写出基态钒原子的价电子 排布式___________ 。
(2)“高温氧化”过程中,若有1
 被氧化,则转移的电子数为
被氧化,则转移的电子数为___________  。
。
(3)“滤渣1”的化学式为___________ 。
(4)“沉硅、沉铝”中得到含铝沉淀的离子方程式为___________ 。
(5)“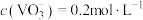 ,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节
,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节 为
为___________  。[已知:
。[已知:
 ]
]
(6)高温还原得到粗钒,也可用铝热反应将 还原为钒,相应的化学方程式为
还原为钒,相应的化学方程式为_________ 。
(7)为适应未来绿电长时储能需求,我国企业开始利用“全钒液流电池”布局大型储能基地。下图为全钒液流电池工作原理示意图,储能时,X电极反应式为___________ 。

 、
、 等形式存在,还有少量的
等形式存在,还有少量的 、
、 等)为原料提取金属钒的工艺流程如图所示。
等)为原料提取金属钒的工艺流程如图所示。
提示:①钒有多种价态,其中+5价最稳定;
②
 在碱性条件下可转化为
在碱性条件下可转化为 。
。(1)写出基态钒原子的
(2)“高温氧化”过程中,若有1

 被氧化,则转移的电子数为
被氧化,则转移的电子数为 。
。(3)“滤渣1”的化学式为
(4)“沉硅、沉铝”中得到含铝沉淀的离子方程式为
(5)“
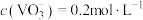 ,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节
,不考虑溶液体积变化,为使钒元素的沉降率达到98%,至少应调节 为
为 。[已知:
。[已知:
 ]
](6)高温还原得到粗钒,也可用铝热反应将
 还原为钒,相应的化学方程式为
还原为钒,相应的化学方程式为(7)为适应未来绿电长时储能需求,我国企业开始利用“全钒液流电池”布局大型储能基地。下图为全钒液流电池工作原理示意图,储能时,X电极反应式为

您最近半年使用:0次