科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_______________ 。检验氨气已装满的方法是_______________ 。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______ (填序号)也可形成喷泉实验。
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气
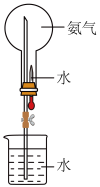
(3)完成氨催化氧化生成为NO的反应方程式_________ ,产物NO有毒,不能排入空气中,若将NO和氧气一起通入水中能生成硝酸的化学方程式:________
(4)2.56gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为____ mol。
(1)写出实验室制取氨气的化学方程式
(2)氨气可用如图装置进行喷泉实验,把氨气换成
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气

(3)完成氨催化氧化生成为NO的反应方程式
(4)2.56gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为
更新时间:2019-04-05 20:20:19
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某课外活动小组在实验室制备氨气。验证氨气的某些性质。
Ⅰ.氨气的制备
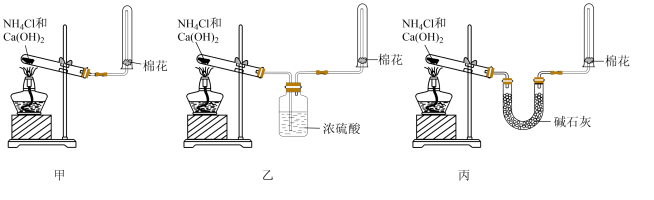
(1)图中三套装置中能制备干燥 的是
的是___________ (“甲”、“乙”、“丙”)。
(2)上述方案中制备 的化学方程式:
的化学方程式:___________ 。
Ⅱ.设计了如图所示的实验收置模拟工业生产制备少量硝酸。
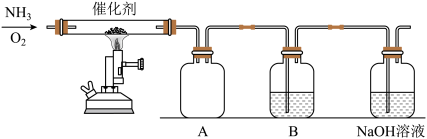
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是___________ (填“吸热”或“放热”)反应,反应的化学方程式为:___________ 。
(4)①A中有红棕色气体产生,生成红棕色气体化学方程式为:___________ 。
②B中试剂为水,生成硝酸的化学方程式为化学方程式为:___________ 。NaOH溶液的作用是___________ 。
Ⅰ.氨气的制备

(1)图中三套装置中能制备干燥
 的是
的是(2)上述方案中制备
 的化学方程式:
的化学方程式:Ⅱ.设计了如图所示的实验收置模拟工业生产制备少量硝酸。

(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是
(4)①A中有红棕色气体产生,生成红棕色气体化学方程式为:
②B中试剂为水,生成硝酸的化学方程式为化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料。某小组同学用如图所示装置制取氨气,并探究其性质。
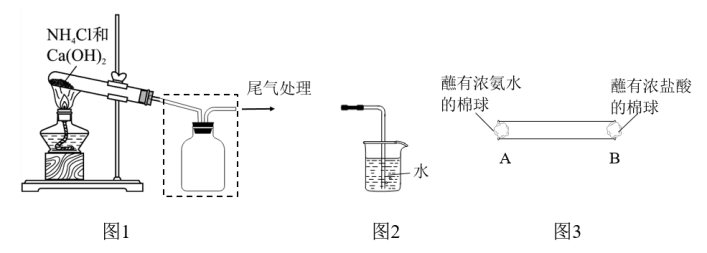
(1)图1试管中发生反应的化学方程式是_______ 。
(2)请将图l方框中的收集装置补充完整_______ 。
(3)图2是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______ 。
(4)如图3所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B处,可观察到的现象是_______ 。
(5)将图3中反应的生成物溶于水得到溶液a,取溶液a少许于试管中,_______ (填操作和现象),则证明溶液a含有 。
。
(6)下列选项中的气体,不能 形成喷泉实验现象的组合是_______。
(7)氨气具有还原性,可与灼热的氧化铜反应,转化为无毒无害的产物,写出反应的化学方程式_______ 。

(1)图1试管中发生反应的化学方程式是
(2)请将图l方框中的收集装置补充完整
(3)图2是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是
(4)如图3所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B处,可观察到的现象是
(5)将图3中反应的生成物溶于水得到溶液a,取溶液a少许于试管中,
 。
。(6)下列选项中的气体,
| A.水、CO2 | B.HCl溶液、NH3气体 |
| C.NaOH溶液、HCl气体 | D.NaOH溶液、CO2气体 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是__________ (双选)。
A.工业合成NH3需要在高温高压下进行 B. NH3可用来生产碳铵和尿素等化肥
C. NH3可用浓硫酸或无水氯化钙干燥 D. NH3受热易分解,须置于冷暗处保存
(2)NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为________________ mol.L-1。
(3)氨气在氧化炉中所发生反应的化学方程式为_____________________________________________ 。
(4)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3+________ +CO2 (请填写完成化学方程式)。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__________ 。

(1)下列有关NH3的说法中,不正确的是
A.工业合成NH3需要在高温高压下进行 B. NH3可用来生产碳铵和尿素等化肥
C. NH3可用浓硫酸或无水氯化钙干燥 D. NH3受热易分解,须置于冷暗处保存
(2)NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
(3)氨气在氧化炉中所发生反应的化学方程式为
(4)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3+
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用
)是大气污染物之一,工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。某同学在实验室中对
。某同学在实验室中对 与
与 反应进行了探究。回答下列问题:
反应进行了探究。回答下列问题:
I.氨气的制备:某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。

(1)实验室制备氨气的化学方程式为_________ ;B中圆底烧瓶收集氨气时,请你选择氨气的进气口______ (填“a”或“b”)。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,你认为引发喷泉的操作应是_______ 。
(3)以下装置可用于吸收多余氨气的是_______ (填序号)。

II.氨气与二氧化氮的反应
(4)铜和浓硝酸产生 的化学方程式是
的化学方程式是__________ 。
(5)将Ⅰ中收集到的 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(4)中产生的
充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(4)中产生的 (两端用夹子
(两端用夹子 、
、 夹好)。
夹好)。
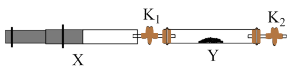
在一定温度下按图示装置进行实验。打开 ,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管中实验现象是
,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管中实验现象是_________ ;反应的化学方程式_________ 。
(6)若有 和
和 的混合物1mol,充分反应。反应后所得到产物中,经氧化得到的
的混合物1mol,充分反应。反应后所得到产物中,经氧化得到的 比经还原得到的
比经还原得到的 多1.4g,则反应混合物中
多1.4g,则反应混合物中 与
与 的体积比是
的体积比是_______ 。
 )是大气污染物之一,工业上在一定温度和催化剂条件下用
)是大气污染物之一,工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。某同学在实验室中对
。某同学在实验室中对 与
与 反应进行了探究。回答下列问题:
反应进行了探究。回答下列问题:I.氨气的制备:某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。

(1)实验室制备氨气的化学方程式为
(2)若观察到装置B中的烧瓶内产生了红色喷泉,你认为引发喷泉的操作应是
(3)以下装置可用于吸收多余氨气的是

II.氨气与二氧化氮的反应
(4)铜和浓硝酸产生
 的化学方程式是
的化学方程式是(5)将Ⅰ中收集到的
 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(4)中产生的
充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(4)中产生的 (两端用夹子
(两端用夹子 、
、 夹好)。
夹好)。
在一定温度下按图示装置进行实验。打开
 ,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管中实验现象是
,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管中实验现象是(6)若有
 和
和 的混合物1mol,充分反应。反应后所得到产物中,经氧化得到的
的混合物1mol,充分反应。反应后所得到产物中,经氧化得到的 比经还原得到的
比经还原得到的 多1.4g,则反应混合物中
多1.4g,则反应混合物中 与
与 的体积比是
的体积比是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】喷泉实验是一种常见的现象,其产生原因是存在压强差。试根据图,回答下列问题:

(1)甲装置为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。下列组合不可能产生喷泉的是___________(填标号,下同)。
(2)在乙装置的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是___________。
(3)丙装置,引发喷泉的操作是___________ 。若在乙装置的锥形瓶中装入水,圆底烧瓶中充满NH3,引发喷泉的操作是___________ 。
(4)实验室中有时可以用Mg3N2同水作用制备氨气,同时生成Mg(OH)2,该反应的化学方程式为___________ 。
(5)液氨可以溶解碱金属单质,反应后溶液呈蓝色。该反应和碱金属单质与水的反应相似,请写出液氨与金属钠反应的化学方程式___________ ;在液氨中,氨分子间存在一种比化学键弱,但比范德华力强的作用,叫做___________ 。

(1)甲装置为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。下列组合不可能产生喷泉的是___________(填标号,下同)。
| A.CO2和饱和NaHCO3溶液 | B.NH3和H2O |
| C.HCl和NaOH溶液 | D.NH3和稀盐酸 |
| A.MnO2与双氧水 | B.Na2SO4与稀硝酸 |
| C.Cu与浓硫酸 | D.Na2SO3与稀硝酸 |
(4)实验室中有时可以用Mg3N2同水作用制备氨气,同时生成Mg(OH)2,该反应的化学方程式为
(5)液氨可以溶解碱金属单质,反应后溶液呈蓝色。该反应和碱金属单质与水的反应相似,请写出液氨与金属钠反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某校化学兴趣小组,在实验室里模拟用N2和H2合成氨,反应的化学方程式为N2+3H2 2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。
2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。
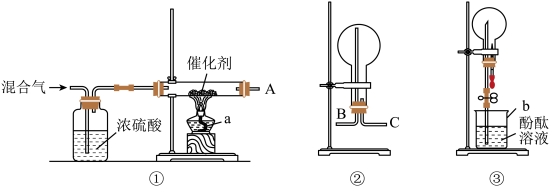
请回答下列问题:
(1)装置①中浓硫酸的作用是________ 。
(2)若用装置②收集反应生成的气体,A应连接装置中的________ (填“B”或“C”);
(3)收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈________ 色。
(4)实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为________ mol/L(气体为标准状况下的体积)
 2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。
2NH3。现用未经干燥的N2和H2按体积比V(N2)∶V(H2)=1∶3充分混合后,按如图所示的装置进行有关实验。 
请回答下列问题:
(1)装置①中浓硫酸的作用是
(2)若用装置②收集反应生成的气体,A应连接装置中的
(3)收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈
(4)实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物是重要的化工原料。回答下列问题:
(1)利用如图所示装置及药品制取氨气。
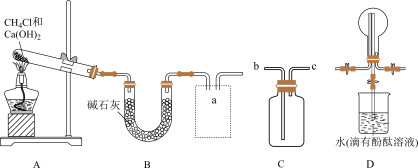
①写出A中制取氨气的化学方程式;___________ 。
②C为方框内氨气的收集装置,则a应与___________ (填“b”或“c”)相连。
③证明氨气已集满的操作和现象是___________ 。
(2)若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是___________ 。
(3)氨经催化氧化可制备硝酸,写出氨催化氧化的化学方程式:___________ 。
(4) 可用碱液吸收:
可用碱液吸收: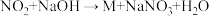 (未配平),已知M是一种盐,且在生成物中M与
(未配平),已知M是一种盐,且在生成物中M与 的物质的量比为
的物质的量比为 。则M的化学名称为
。则M的化学名称为___________ 。
(5)将mgCu与足量的稀硝酸混合,充分反应后,收集到2.24L(标准状况)气体,则
___________ 。
(1)利用如图所示装置及药品制取氨气。

①写出A中制取氨气的化学方程式;
②C为方框内氨气的收集装置,则a应与
③证明氨气已集满的操作和现象是
(2)若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是
(3)氨经催化氧化可制备硝酸,写出氨催化氧化的化学方程式:
(4)
 可用碱液吸收:
可用碱液吸收: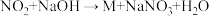 (未配平),已知M是一种盐,且在生成物中M与
(未配平),已知M是一种盐,且在生成物中M与 的物质的量比为
的物质的量比为 。则M的化学名称为
。则M的化学名称为(5)将mgCu与足量的稀硝酸混合,充分反应后,收集到2.24L(标准状况)气体,则

您最近一年使用:0次
【推荐2】某化学兴趣小组在教师的指导下,利用如图所示装置(夹持和加热装置已省略)和试剂进行NH3的制备及性质探究的一体化实验。请回答下列问题:___________ ;乙处瓶内观察到的现象为___________ ;丙处烧杯中的试剂为稀硫酸,丙处球形干燥管的作用是___________ 。
(2)一段时间后关闭K1,打开K2,丁处瓶内发生反应的离子方程式为___________ ;继续反应一段时间后,关闭K2、K4,打开K3,挤压胶头滴管,己处圆底烧瓶内能观察到的现象为___________ 。
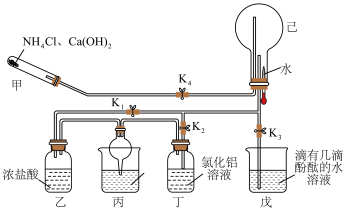
(3)甲装置可以用如图所示装置代替,试剂a可选择___________ (填试剂名称)。氨的催化氧化是工业制硝酸的基础,氨与氧气在催化剂作用下发生反应生成氮的氧化物时,氧化剂和还原剂的物质的量之比为___________ 。
(2)一段时间后关闭K1,打开K2,丁处瓶内发生反应的离子方程式为
(3)甲装置可以用如图所示装置代替,试剂a可选择
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学学习小组设计实验制取氨气并探究氨气的有关性质:
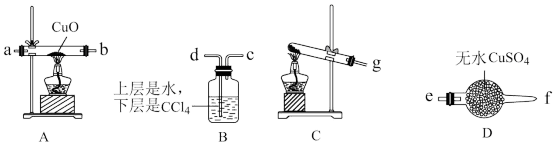
(1)已知NH3难溶于有机溶剂CCl4,该小组成员设计实验制备氨气并探究氨气的还原性及产物 ,提供实验装置如图:______
②根据上述提供的装置正确的连接顺序为______ (用各接口序号表示)
③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________ 。
(2)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式______
(3)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O___________ 。(已知:Cu2O+2H+=Cu+Cu2+ +H2O)
(4)按下图装置进行NH3性质实验。___________ ,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________ 。
(1)已知NH3难溶于有机溶剂CCl4,该小组成员设计实验制备氨气并探究
②根据上述提供的装置正确的连接顺序为
③该装置在设计上有一定的缺陷,你对该装置的改进措施是
(2)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式
(3)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
(4)按下图装置进行NH3性质实验。
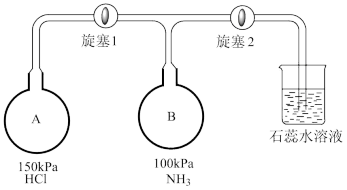
②再打开旋塞2,B瓶中的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_____ 。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
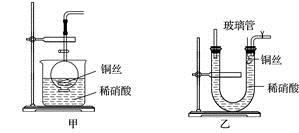
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是____ (填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____ (填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______ 。
②让反应停止的操作方法及原因是_____ 。
(4)以下收集NO气体的装置,合理的是___ (填序号)。
(5)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
①NO的体积为_____ L,NO2的体积为____ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___ mol·L-1。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是
②让反应停止的操作方法及原因是
(4)以下收集NO气体的装置,合理的是

(5)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
①NO的体积为
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某小组同学利用下面的实验装置(气密性已检验,试管内预先充满氮气)验证硝酸的性质。
试填空:
(1)步骤i中,红棕色气体是___________ 。
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是___________ 。
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为___________ 。
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由___________ 。
| 实验装置 | 实验步骤 | 实验现象 |
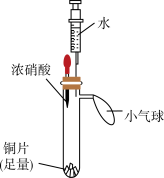 | i.挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ii.一段时间后,推动注射器活塞,使水全部进入试管 | 铜片表面产生气泡,溶液变蓝,试管内气体逐渐变为无色 | |
| iii. 试管内气体变为无色后,拉动注射器活塞,吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
(1)步骤i中,红棕色气体是
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】利用下图所示装置进行铜与硝酸反应的实验,得到的实验现象如下表:
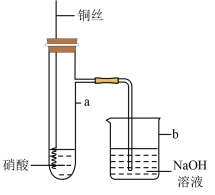
(1)装置中a的仪器名称为_______ ;组装好装置后进行实验之前需先进行_______ 。
(2)写出实验Ⅰ中产生的无色气体化学式_______ 。
(3)写出实验Ⅱ中铜与浓硝酸反应的离子方程式_______ 。
(4)装置中采用可拉动铜丝的优点是_______ (写一点)。
(5)针对Ⅰ中溶液呈蓝色,Ⅱ中溶液呈绿色。甲同学推测溶液的颜色与硝酸铜的质量分数有关,而乙同学推测Ⅱ中溶液呈绿色的原因是 在硝酸铜溶液中达到饱和所致。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______。
在硝酸铜溶液中达到饱和所致。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______。

| 序号 | 实验试剂(20℃) | 实验现象 |
| Ⅰ | 铜丝、2mL稀硝酸 | 铜丝逐渐变细,有气泡产生,a中先产生无色气体后略有红棕色,溶液变蓝 |
| Ⅱ | 铜丝、2mL浓硝酸 | 反应剧烈,铜丝逐渐变细,a中上方出现红棕色气体,溶液变绿 |
(2)写出实验Ⅰ中产生的无色气体化学式
(3)写出实验Ⅱ中铜与浓硝酸反应的离子方程式
(4)装置中采用可拉动铜丝的优点是
(5)针对Ⅰ中溶液呈蓝色,Ⅱ中溶液呈绿色。甲同学推测溶液的颜色与硝酸铜的质量分数有关,而乙同学推测Ⅱ中溶液呈绿色的原因是
 在硝酸铜溶液中达到饱和所致。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______。
在硝酸铜溶液中达到饱和所致。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______。| A.加热绿色溶液,观察颜色变化 |
| B.加水稀释绿色溶液,观察颜色变化 |
| C.向绿色溶液中通入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
您最近一年使用:0次



