(1)某温度(t℃)时,测得0.01 mol·L-1 NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw=________ 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb=________ 。
(2)25℃时,pH=a的20mL的H2SO4溶液与c(H+)=10-b的200mL的NaOH溶液混合后,溶液呈中性,则a和b满足的关系_______ 。
①该温度下水的Kw=
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb=
(2)25℃时,pH=a的20mL的H2SO4溶液与c(H+)=10-b的200mL的NaOH溶液混合后,溶液呈中性,则a和b满足的关系
更新时间:2019-06-11 08:44:51
|
相似题推荐
计算题
|
较难
(0.4)
名校
【推荐1】规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为_____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b=____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 mol•L-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________ (用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b=
②若所得混合溶液pH=3,则a:b=
(4)已知某温度时0.1 mol•L-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】水中的酸碱平衡。一个溶液(X)含有两种一元弱酸(只有一个具有酸性的质子); HA的酸解离常数KHA= 1.74 ×10-7, HB的酸解离常数KHB= 1.34 ×10-7溶液XpH为3.75。
(1).滴定完100 mL溶液X需要100 mL 0.220 M NaOH溶液。计算溶液X中每一种酸的最初的(总量)浓度(mol·L-1)___________ 。在适当的地方合理近似[Kw= 1.00 × 10-14,298K。 ]
(2).计算最初包含6.00 × 10-2 M NaA与4.00 × 10-2 M NaB的溶液Y的pH___________ 。
(3).向溶液X中加入许多蒸馏水得到非常(无限)稀的溶液,酸的总浓度接近于零。计算稀溶液中每一种酸的解离百分数___________ 。
(4).将一个缓冲溶液加到溶液Y中,保持pH为10.0. 得到溶液Z,假定体积无变化。计算物质M(OH)2 在Z中的溶解度___________ (用mol·L-1)。已知阴离子A-与B-可与M2+形成络合物:
M(OH)2 ⇌ M2+ + 2OH- Ksp=3. 10 ×10-12
M2++A- ⇌ [MA]+ K1=2.1 × 103
[MA]++ A- -⇌ [MA2] K2=5.0 × 102
M2++B- ⇌ [MB]+ K =6.2 × 103
=6.2 × 103
[MB]++B- ⇌ [MB2] K =3.3 × 102
=3.3 × 102
(1).滴定完100 mL溶液X需要100 mL 0.220 M NaOH溶液。计算溶液X中每一种酸的最初的(总量)浓度(mol·L-1)
(2).计算最初包含6.00 × 10-2 M NaA与4.00 × 10-2 M NaB的溶液Y的pH
(3).向溶液X中加入许多蒸馏水得到非常(无限)稀的溶液,酸的总浓度接近于零。计算稀溶液中每一种酸的解离百分数
(4).将一个缓冲溶液加到溶液Y中,保持pH为10.0. 得到溶液Z,假定体积无变化。计算物质M(OH)2 在Z中的溶解度
M(OH)2 ⇌ M2+ + 2OH- Ksp=3. 10 ×10-12
M2++A- ⇌ [MA]+ K1=2.1 × 103
[MA]++ A- -⇌ [MA2] K2=5.0 × 102
M2++B- ⇌ [MB]+ K
 =6.2 × 103
=6.2 × 103[MB]++B- ⇌ [MB2] K
 =3.3 × 102
=3.3 × 102
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐1】完成下列问题
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为_______ 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=_______ ,若温度不变,0.005 mol·L-1的H2SO4溶液中,由水电离出的c(H+)=_______ 。
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=_______ ;此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为_______ 。
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO )约为
)约为_______ 。
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO
 )约为
)约为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】下表是不同温度下水的离子积数据:
试回答以下问题:
(1)若25<t1<t2,则a__ 1×10-14(填“>”、“<”或“=”),作此判断的理由是___ 。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___ 。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___ 。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___ 。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___ pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___ V(盐酸)。
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】回答下列问题:
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中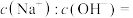
______
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入______ mL0.1mol/L的NaOH,可使反应所得的溶液pH=7(用含Ka的式子表达)
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=______
(4)常温下,设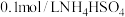 溶液的pH为a,则
溶液的pH为a,则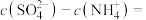
______ (用含a的精确式子表达)
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中
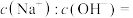
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的
 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=(4)常温下,设
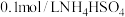 溶液的pH为a,则
溶液的pH为a,则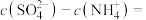
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐1】有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】现有浓度均为0.1mol•L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵。请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)__ 。
(2)已知T℃,KW=1×10-13,则t℃___ 25℃(填“>”、“<”或“=”)。在T℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=_ 。
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=__ (填数据);
②若x+y>14,则a/b=__ (填表达式);
③该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为__ (填表达式)。
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)已知T℃,KW=1×10-13,则t℃
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=
②若x+y>14,则a/b=
③该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】已知水在25℃和95℃时的电离平衡曲线如图所示:

(1)25℃时水的电离平衡曲线应为___ (填“A”或“B”)。
(2)95℃时水的离子积Kw=___ 。
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___ 。
(4)95℃时,若100 mLpH1=a的某强酸溶液与1mLpH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___ 。
(5)在曲线B对应的温度下,将pH=2的某HA溶液和pH=10的NaOH溶液等体积混合,所得溶液的pH=5。请分析其原因:___ 。

(1)25℃时水的电离平衡曲线应为
(2)95℃时水的离子积Kw=
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)95℃时,若100 mLpH1=a的某强酸溶液与1mLpH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
(5)在曲线B对应的温度下,将pH=2的某HA溶液和pH=10的NaOH溶液等体积混合,所得溶液的pH=5。请分析其原因:
您最近一年使用:0次



