随原子序数递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1) f在周期表中的位置是__________ 。
(2) 比较d、e常见离子的半径大小(用化学式表示,下同):____ >____ ;比较g、h的最高价氧化物对应水化物的酸性强弱:____ >____ 。
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式:____ 。
(4)f和h形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________ 。
(5) 上述元素可组成盐R: zx4f(gd4)2,向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①m点反应的离子方程式:________________ 。
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______ mol。

根据判断出的元素回答问题:
(1) f在周期表中的位置是
(2) 比较d、e常见离子的半径大小(用化学式表示,下同):
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式:
(4)f和h形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该化合物是
(5) 上述元素可组成盐R: zx4f(gd4)2,向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①m点反应的离子方程式:
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
更新时间:2019-07-02 10:26:31
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440mL甲溶液与120mL乙溶液反应,产生1.56g沉淀;
②取120mL甲溶液与440mL乙溶液反应,也产生1.56g沉淀;
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为_________ 溶液,其物质的量浓度是_________ mol/L;乙溶液为_________ 溶液,其物质的量浓度是_________ mol/L.
(2)写出实验③的有关离子方程式:__________ .
①取440mL甲溶液与120mL乙溶液反应,产生1.56g沉淀;
②取120mL甲溶液与440mL乙溶液反应,也产生1.56g沉淀;
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为
(2)写出实验③的有关离子方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】向100mL 3mol·L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol·L-1Ba(OH)2溶液。
(1)写出当刚好出现沉淀物质的量总量的最大值时的离子方程式(用一个式子表示):
_________________________________________________________________________ 。
(2)随着Ba(OH)2溶液体积的变化,沉淀总物质的量的变化如下图所示(Y代表沉淀总物质的量/mol;X代表Ba(OH)2溶液体积/mL)。写出b点和c点所对应的Ba(OH)2溶液的体积:b______ mL,c_______ mL。

(1)写出当刚好出现沉淀物质的量总量的最大值时的离子方程式(用一个式子表示):
(2)随着Ba(OH)2溶液体积的变化,沉淀总物质的量的变化如下图所示(Y代表沉淀总物质的量/mol;X代表Ba(OH)2溶液体积/mL)。写出b点和c点所对应的Ba(OH)2溶液的体积:b

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL,4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)BC对应反应的离子方程式为____________ ;
(2)运用高中阶段方法检验B点溶液中阳离子,现象是__________________________
(3)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为_____________ 。
(4)c(KOH)=_________ mol/L,混合物中氧化铝的物质的量为_____ mol;

(1)BC对应反应的离子方程式为
(2)运用高中阶段方法检验B点溶液中阳离子,现象是
(3)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为
(4)c(KOH)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】I.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1)Si在元素周期表中的位置是_______ 。
(2)根据用途推测SiO2在水中的溶解性:_______ (填“易溶”或“难溶”)。
(3)制备SiO2的方法如图:
Na2SiO3溶液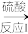 H2SiO3沉淀
H2SiO3沉淀 SiO2
SiO2
①写出反应I的离子方程式_______ 。
②比较酸性强弱:H2SO4_______ H2SiO3(填“>”或“<”)。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是_______ (填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
II.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
(1)K2FeO4中铁元素的化合价为_______ 。
(2)制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确 的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整: 4K2FeO4 + H2O = Fe(OH)3(胶体)+_____ + KOH
______
(5)消毒净化500 m3水,至少需要K2FeO4的质量为_______ kg。
(1)Si在元素周期表中的位置是
(2)根据用途推测SiO2在水中的溶解性:
(3)制备SiO2的方法如图:
Na2SiO3溶液
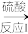 H2SiO3沉淀
H2SiO3沉淀 SiO2
SiO2①写出反应I的离子方程式
②比较酸性强弱:H2SO4
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
II.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
| 【化学式】K2FeO4 【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1 L水投放5 mg K2FeO4即可达到卫生标准 |
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整: 4K2FeO4 + H2O = Fe(OH)3(胶体)+_____ + KOH
(5)消毒净化500 m3水,至少需要K2FeO4的质量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________ 。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_______ >__________ ;比较g、h的最高价氧化物对应水化物的酸性强弱:_______ >__________ 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________ 。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:____________________________ 。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:

①写出m点反应的离子方程式:____________________________ 。
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______ mol。

根据判断回答下列问题:
(1)f在周期表中的位置是
(2)比较d、e常见离子的半径大小(用化学式表示,下同):
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:
(4)写出e的单质在足量d2中燃烧反应的化学方程式:
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:

①写出m点反应的离子方程式:
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】W、X、Y、Z 是原子序数依次增大的四种短周期元素。W 的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,W、X、Y、Z 的最外层电子数之和为 16。回答下列问题:
(1)Z 单质的电子式是________________ 。W 的气态氢化物能使紫色石蕊溶液变蓝的原因:__________________ (用化学方程式表示)。
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是:_____ 。
(3)Z 最高价氧化物对应的水化物化学式为____ 。
(4)Z 和氧元素、硫元素组成的 SOZ2 是一种液态化合物,沸点为 77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出, 该气体可使滴有品红试液的滤纸褪色。请写出 SOZ2 和水反应的化学方程式_____ 。
(1)Z 单质的电子式是
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是:
(3)Z 最高价氧化物对应的水化物化学式为
(4)Z 和氧元素、硫元素组成的 SOZ2 是一种液态化合物,沸点为 77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出, 该气体可使滴有品红试液的滤纸褪色。请写出 SOZ2 和水反应的化学方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】有A、B、C、D、E五种短周期元素,其元素特征信息如下表,回答下列问题:
(1)写出下列元素的名称:C________ ,E________ ;元素E在元素周期表中的位置是__________ 。
(2)写出A、B、C形成的化合物M的电子式________ ;B和C的离子中,半径较小的是______ (填离子符号 );五种原子中半径最大的是________ (填元素符号 )。五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)________________________________ 。
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________ 。
(4)D单质与M的水溶液反应的离子方程式:________ 。
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C
(2)写出A、B、C形成的化合物M的电子式
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为
(4)D单质与M的水溶液反应的离子方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图是自然界中氮的循环图,请分析此图并回答有关问题.
(1)大气中的氮以_____ (填化学式)形式存在。图中共表示了_______ 种固氮的途径。
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为___________ 。土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O N2+K2SO4+KOH
N2+K2SO4+KOH
(3)上述反应中涉及1~18号元素的原子半径从大到小的顺序是_________________ 。属于共价化合物的反应物(或生成物)的结构式是_____________ 。
(4)配平上述反应方程式,并标出电子转移的方向和数目_____________ 。上述反应的氧化剂是_________________ ,被氧化的元素是____________________ 。
(5)上述过程的发生改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:_______________________ 。
(6)工业合成氨的简易流程如下图,通过循环Ⅰ可利用的气态物质是_____________

a.催化剂 b.只有N2 c.只有H2 d.N2和H2

(1)大气中的氮以
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为
 N2+K2SO4+KOH
N2+K2SO4+KOH(3)上述反应中涉及1~18号元素的原子半径从大到小的顺序是
(4)配平上述反应方程式,并标出电子转移的方向和数目
(5)上述过程的发生改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:
(6)工业合成氨的简易流程如下图,通过循环Ⅰ可利用的气态物质是

a.催化剂 b.只有N2 c.只有H2 d.N2和H2
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】冰晶石是金属铝冶炼时的助溶剂,工业上制取冰晶石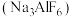 的化学方程式如下:
的化学方程式如下: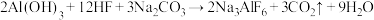 ;根据题意完成下列填空:
;根据题意完成下列填空:
(1)铝原子核外电子占据_______ 个轨道,最外层电子云伸展方向有_______ 种,某元素与铝元素不同周期但在相邻一族,且性质和铝元素十分相似,该元素原子核外电子排布式为_______ 。
(2)冰晶石中存在的化学键_______ ,在上述反应的反应物和生成物中,属于非极性分子的电子式_______ ,属于弱酸的电离方程式_______ 。
(3)金属铝冶炼时,使用助熔剂冰晶石,是因为原料 的高熔点,为什么原料不选用熔点更低的
的高熔点,为什么原料不选用熔点更低的 ?
?_______
(4)在电解法发明前,金属铝是用更活泼的金属通过置换反应来生产的,所以价格非常昂贵,为什么不使用相对廉价的碳或氢气进行置换呢?_______
(5)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是_______(选填编号)。
(6) 俗称纯碱,属于
俗称纯碱,属于_______ 晶体。工业上制取纯碱的原料是_______ 。
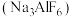 的化学方程式如下:
的化学方程式如下: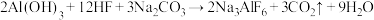 ;根据题意完成下列填空:
;根据题意完成下列填空:(1)铝原子核外电子占据
(2)冰晶石中存在的化学键
(3)金属铝冶炼时,使用助熔剂冰晶石,是因为原料
 的高熔点,为什么原料不选用熔点更低的
的高熔点,为什么原料不选用熔点更低的 ?
?(4)在电解法发明前,金属铝是用更活泼的金属通过置换反应来生产的,所以价格非常昂贵,为什么不使用相对廉价的碳或氢气进行置换呢?
(5)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是_______(选填编号)。
| A.气态氢化物的稳定性 | B.最高价氧化物对应水化物的酸性 |
| C.单质与氢气反应的难易 | D.单质与同浓度酸发生反应的快慢 |
 俗称纯碱,属于
俗称纯碱,属于
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】(1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):
请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________ ,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________ 。
②上述配离子中含有的化学键类型有:__________________ 。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______ ;其中铜离子的配位数是_______ 。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____ ;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______ 和______ (填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________ 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________ (写2种)。

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是
②上述配离子中含有的化学键类型有:
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为
②Fe元素位于周期表的
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为
③根据VSEPR理论预测ED4-离子的空间构型为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】镍在金属羰基化合物(金属元素和CO中性分子形成的一类配合物)、金属储氢材料(能可逆地多次吸收、储存和释放H2的合金)等领域用途广泛。
(1)基态Ni原子核外电子排布式为__________________________ 。
(2)Ni(CO)4中镍元素的化合价为__________ ,写出与CO互为等电子体的带一个单位正电荷的阳离子为:_______ 。Ni(CO)4的一氯代物有2种,其空间构型为_______________ o
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示,则该晶体的化学式为_____________

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式:_______________ 。

与Ni2+配位的N原子有__________ 个,该配合物中存在的化学键有_________ (填序号)。
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(5)Ni与Fe的构型相同(体心立方堆积),Ni的摩尔质量为M g/mol,阿伏伽德罗常数为NA,密度为a g/cm3Ni原子的半径为_________ pm(金属小球刚性相切)
(1)基态Ni原子核外电子排布式为
(2)Ni(CO)4中镍元素的化合价为
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示,则该晶体的化学式为

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式:

与Ni2+配位的N原子有
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(5)Ni与Fe的构型相同(体心立方堆积),Ni的摩尔质量为M g/mol,阿伏伽德罗常数为NA,密度为a g/cm3Ni原子的半径为
您最近一年使用:0次



