常温下,0.1 mol·L-1 HA溶液中c(H+)=10-3mol·L-1,下列说法中正确的是
| A.HA是一种强酸 |
| B.相同浓度的HCl溶液与HA溶液,后者的导电能力更强 |
| C.在HA溶液中存在:c(H+)=c(A-)+c(OH-) |
| D.中和同体积同浓度的HCl和HA溶液,消耗同浓度的NaOH溶液的体积不同 |
18-19高一下·浙江嘉兴·期末 查看更多[3]
更新时间:2019-06-29 14:20:24
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列关于化学平衡常数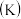 ,电离平衡常数
,电离平衡常数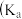 或
或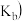 ,水解平衡常数
,水解平衡常数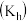 ,沉淀溶解平衡常数
,沉淀溶解平衡常数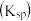 ,水的离子积常数
,水的离子积常数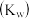 的叙述中错误的是
的叙述中错误的是

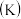 ,电离平衡常数
,电离平衡常数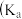 或
或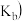 ,水解平衡常数
,水解平衡常数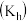 ,沉淀溶解平衡常数
,沉淀溶解平衡常数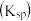 ,水的离子积常数
,水的离子积常数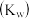 的叙述中错误的是
的叙述中错误的是

A.K值越大,正反应进行的程度越大,一般地说,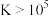 时,该反应进行得就基本完全了 时,该反应进行得就基本完全了 |
B.比较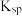 与离子积 与离子积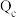 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
C.K、 或 或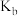 、 、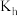 、 、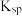 、 、 都与温度有关,温度越高,常数值越大 都与温度有关,温度越高,常数值越大 |
D.弱酸HA的 与NaA的 与NaA的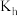 、水的离子积常数 、水的离子积常数 三者间的关系可表示为: 三者间的关系可表示为: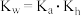 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列过程中的化学反应,相应的离子方程式正确的是
| H2CO3 | Ka1=4.30×10-7 | Ka2=5.61×10-11 | H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
| HClO | Ka=2.95×10-8 | H2S | Ka1=9.1×10-8 | Ka2=1.1×10-12 |
| A.CuCl2溶液中通入H2S气体:Cu2++S2-=CuS↓ |
B.NaClO溶液中通少量CO2:ClO-+CO2+H2O=HClO+HCO |
C.向Na2S溶液中通入少量SO2:S2-+SO2+H2O=SO +H2S +H2S |
D.Na2CO3溶液中通入过量SO2:CO +SO2=SO +SO2=SO +CO2 +CO2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】25 ℃时,有c(CH3COOH)+c(CH3COO−)=0.1 mol·L−1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO−)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是


| A.由题给图示可求出25 ℃时醋酸的电离平衡常数Ka=10−4.75 |
| B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH−) |
| C.pH=3.5的溶液中:c(Na+)+c(H+)−c(OH−)+c(CH3COOH)=0.1 mol·L−1 |
| D.向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH−) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )


| A.因为两种酸溶液的pH相等,故V1一定等于V2 |
| B.若V1>V2,则说明HA为强酸,HB为弱酸 |
| C.若实验①中,V=V1,则混合液中c(Na+)=c(A-) |
| D.实验②的混合溶液,可能有pH<7 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】部分弱酸的电离常数如下表:
下列有关说法正确的是
弱酸 | HCOOH | HCN | H2S |
电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9 X 10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A.恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 |
| B.HCOO-、CN-、HS-在溶液中不可以大量共存 |
| C.NaHS溶液中加入适量KOH后:c (Na+)=c (H2S) +c (HS-) +2c (S2-) |
| D.等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN |
您最近一年使用:0次

 溶液,
溶液, 相等
相等 和体积均相等的盐酸、
和体积均相等的盐酸、 溶液,所需
溶液,所需 的
的 的
的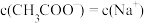
 完全反应,盐酸产生的
完全反应,盐酸产生的 多
多

