已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
| A.-(3Q1-Q2+Q3) kJ | B.-0.5(Q1+Q2+Q3) kJ |
| C.-(0.5Q1-1.5Q2+0.5Q3) kJ | D.-(Q1+Q2+Q3) kJ |
更新时间:2019-07-15 14:38:06
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】知某物质的标准生成焓(△f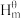 )的定义为用标准状态下的各种元素的最稳定单质,生成标准状态下1mol该物质所吸收或放出的能量,其中△f
)的定义为用标准状态下的各种元素的最稳定单质,生成标准状态下1mol该物质所吸收或放出的能量,其中△f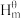 (单质)=0kJ/mor。N2O、CO、CO2的标准生成焓分别为82.1kJ/mol、110.5kJ/mol、-393.5kJ/mol。研究表明N2O与CO在Fe+的催化下发生反应NO(g)+CO(g)=N2(g)+CO2(g),△H的能量变化及反应历程如图所示,下列说法错误的是
(单质)=0kJ/mor。N2O、CO、CO2的标准生成焓分别为82.1kJ/mol、110.5kJ/mol、-393.5kJ/mol。研究表明N2O与CO在Fe+的催化下发生反应NO(g)+CO(g)=N2(g)+CO2(g),△H的能量变化及反应历程如图所示,下列说法错误的是
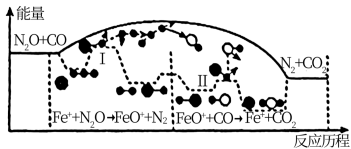
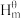 )的定义为用标准状态下的各种元素的最稳定单质,生成标准状态下1mol该物质所吸收或放出的能量,其中△f
)的定义为用标准状态下的各种元素的最稳定单质,生成标准状态下1mol该物质所吸收或放出的能量,其中△f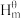 (单质)=0kJ/mor。N2O、CO、CO2的标准生成焓分别为82.1kJ/mol、110.5kJ/mol、-393.5kJ/mol。研究表明N2O与CO在Fe+的催化下发生反应NO(g)+CO(g)=N2(g)+CO2(g),△H的能量变化及反应历程如图所示,下列说法错误的是
(单质)=0kJ/mor。N2O、CO、CO2的标准生成焓分别为82.1kJ/mol、110.5kJ/mol、-393.5kJ/mol。研究表明N2O与CO在Fe+的催化下发生反应NO(g)+CO(g)=N2(g)+CO2(g),△H的能量变化及反应历程如图所示,下列说法错误的是
| A.△H=-36.1kJ/mol |
| B.由过程I可得N2O的能量要高于N2的能量 |
| C.催化剂会改变反应途径和降低反应活化能,且反应速率由过程I决定 |
| D.在过程II中同时存在碳氧键的断裂和形成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法不正确的是
| A.已知:①Fe(s)+1/2O2(g)==FeO(s);△H1= -272 kJ/mol; ②2Al(s)+3/2O2(g)==Al2O3(s);△H2= -1675kJ/mol, 则2Al(s)+3FeO(s)= Al2O3(s)+3Fe(s);△H= -859 kJ/mol |
| B.25℃时,向10mL物质的量浓度均为0.10mol/LNaOH和NH3·H2O的混合溶液中,逐滴滴加 10mL0.10mol/L 盐酸,混合溶液中 c(NH4+)+c(H+)=c(OH-) |
| C.25℃时,向0.10mol/LNaHSO3溶液中通入NH3至溶液PH=7(体积变化忽略),则有: c(Na+)>c(NH4+)>c(SO32-) |
| D.比较Na2S2O3溶液与不同浓度稀硫酸反应速率的快慢是通过测定出现黄色沉淀的快慢来比较的,而不是采用排水法测量单位时间内气体体积的大小进行比较的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】由金红石(TiO2)制取单质Ti涉及的步骤为:TiO2→TiCl4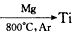
已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3=+141 kJ·mol-1
则TiO2(s) +2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H是
已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3=+141 kJ·mol-1
则TiO2(s) +2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H是
| A.-80 kJ·mol-1 | B.-160 kJ·mol-1 | C.+160 kJ·mol-1 | D.+80kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】已知25°C、101 kPa时,
①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;
②2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
③2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
下列判断不正确的是
①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;
②2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
③2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
下列判断不正确的是
| A.6 g碳完全燃烧时放出热量196.75 kJ |
| B.反应②可以自发进行 |
| C.H2的燃烧热ΔH= -241.8 kJ/mol |
| D.制备水煤气的热化学反应方程式为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3 kJ/mol |
您最近一年使用:0次
【推荐2】氢化热是指一定条件下,lmol不饱和化合物加氢时放出的热量。表中是环己烯(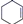 )、环己二烯(
)、环己二烯( )和苯的氢化热数据:
)和苯的氢化热数据:
根据表中数据推断正确的是
 )、环己二烯(
)、环己二烯( )和苯的氢化热数据:
)和苯的氢化热数据:| 物质 | 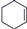 +H2 +H2 |  +2H2 +2H2 | 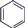 +3H2 +3H2 |
| 氢化热(kJ·mol-1) | -119.7 | -232.7 | -208.4 |
| A.环己烯、环己二烯和苯分别跟氢气反应,环己二烯跟氢气反应最剧烈 |
| B.环己烯、环己二烯和苯都含有相同的官能团 |
| C.环己烯、环己二烯和苯相比较,环己二烯最稳定 |
D.上述条件下,lmol 转变为 转变为 时放出热量 时放出热量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的。
已知:H2O(g) ═ H2O(l) ΔH1= -Q1 kJ•mol-1①
C2H5OH(g) ═ C2H5OH(l) ΔH2= -Q2 kJ•mol-1 ②
C2H5OH(g)+3O2(g) ═ 2CO2(g)+3H2O(g) ΔH3= -Q3 kJ•mol-1③
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
已知:H2O(g) ═ H2O(l) ΔH1= -Q1 kJ•mol-1①
C2H5OH(g) ═ C2H5OH(l) ΔH2= -Q2 kJ•mol-1 ②
C2H5OH(g)+3O2(g) ═ 2CO2(g)+3H2O(g) ΔH3= -Q3 kJ•mol-1③
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
| A.Q1+Q2+Q3 | B.Q3-Q2+Q1 | C.Q3-Q2+3Q1 | D.Q3-Q2-3Q1 |
您最近一年使用:0次



