MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
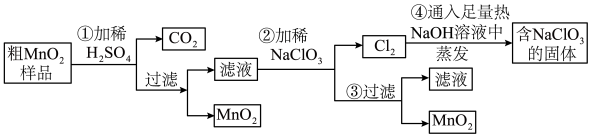
回答下列问题:
(1)第②步操作中,氧化性强弱顺序:ClO3-________ (填“>”或“<”)MnO2,当NaClO3转移2 mol电子时,生成的氧化产物的物质的量为________ mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________ 。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_____ (填字母)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____________ 。
(4)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的方程式为:8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O,所得混合气体的平均式量为_______ 。

回答下列问题:
(1)第②步操作中,氧化性强弱顺序:ClO3-
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的
a. NaCl b. NaClO c. NaClO4 d. NaOH
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为
(4)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的方程式为:8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O,所得混合气体的平均式量为
更新时间:2019-07-20 18:55:02
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室研究不同价态铜元素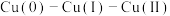 之间的转化。
之间的转化。
I.研究 、
、 的转化
的转化
(1)下列试剂能实现 转化的是
转化的是_________ 。
A.硫黄 B.氯气 C.硝酸
(2)两种转化所需试剂在性质上具有的共性和差异性是_________ 。
II.研究 的转化
的转化
已知: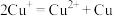
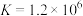
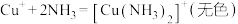
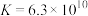
 在空气中极易被氧化为
在空气中极易被氧化为
设计实验方案如下:

(3)实验a中反应难以发生的原因是_________ 。
(4)实验b中反应的离子方程式为_________ 。
(5)甲预测 溶液与KI溶液混合也能实现
溶液与KI溶液混合也能实现 转化。
转化。
①甲预测的理由是_________ 。
②为了验证猜测,甲进行实验c:向 溶液中加入KI溶液,观察到溶液变为棕色,并伴有浑浊产生。
溶液中加入KI溶液,观察到溶液变为棕色,并伴有浑浊产生。
i.仅依据溶液变为棕色这一现象,是否能证明实现了 的转化,说明判断理由是
的转化,说明判断理由是_________ 。
ii.证实实验c中实现了 转化的实验方案是
转化的实验方案是_________ 。
(6)乙认为 与
与 也能反应得到
也能反应得到 ,但将两溶液混合后只得到了CuS。
,但将两溶液混合后只得到了CuS。
① 与
与 反应没有生成
反应没有生成 的原因
的原因_________ 。
②乙利用上述实验中的试剂,改进实验方案,证明 在一定条件下可以将
在一定条件下可以将 转化为+1价Cu,并进一步得到了
转化为+1价Cu,并进一步得到了 ,实验方案是
,实验方案是_________ 。
 之间的转化。
之间的转化。I.研究
 、
、 的转化
的转化(1)下列试剂能实现
 转化的是
转化的是A.硫黄 B.氯气 C.硝酸
(2)两种转化所需试剂在性质上具有的共性和差异性是
II.研究
 的转化
的转化已知:
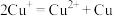
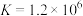
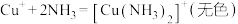
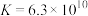
 在空气中极易被氧化为
在空气中极易被氧化为
| 物质 | CuCl(白色) | CuI(白色) |  (黑色) (黑色) | CuS(黑色) |
 | 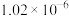 | 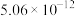 | 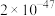 | 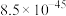 |

(3)实验a中反应难以发生的原因是
(4)实验b中反应的离子方程式为
(5)甲预测
 溶液与KI溶液混合也能实现
溶液与KI溶液混合也能实现 转化。
转化。①甲预测的理由是
②为了验证猜测,甲进行实验c:向
 溶液中加入KI溶液,观察到溶液变为棕色,并伴有浑浊产生。
溶液中加入KI溶液,观察到溶液变为棕色,并伴有浑浊产生。i.仅依据溶液变为棕色这一现象,是否能证明实现了
 的转化,说明判断理由是
的转化,说明判断理由是ii.证实实验c中实现了
 转化的实验方案是
转化的实验方案是(6)乙认为
 与
与 也能反应得到
也能反应得到 ,但将两溶液混合后只得到了CuS。
,但将两溶液混合后只得到了CuS。①
 与
与 反应没有生成
反应没有生成 的原因
的原因②乙利用上述实验中的试剂,改进实验方案,证明
 在一定条件下可以将
在一定条件下可以将 转化为+1价Cu,并进一步得到了
转化为+1价Cu,并进一步得到了 ,实验方案是
,实验方案是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某实验小组想探究实验室用MnO2与盐酸反应制取氯气的反应条件,实验装置及药品如下。
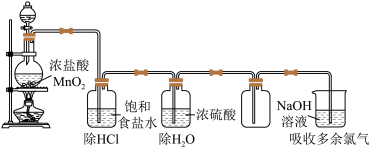
(1)写出实验室制氯气的离子方程式_______ 。
(2)结合平衡移动原理,解释饱和食盐水的作用是_______ 。
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
MnO2与盐酸的反应是_______ 反应(填“放热”或“吸热”)。
(4)为探究条件对该反应的影响,小组同学设计并完成以下实验:
①根据上述实验可知MnO2与盐酸产生氯气的反应条件为_______ 。
②针对实验1和实验3的现象,小组同学从电极反应角度分析物质氧化性和还原性的变化规律。
写出实验中制氯气反应的电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:_______ 。
提出假设:
ⅰ.增大c(H+),可以_______ 。
ⅱ.增大c(Cl-),可以增大Cl-的还原性。
③补充实验,实验II、III分别证实了②中的分析。
(固液混合物A为一定浓度的盐酸和MnO2混合物;加热装置已略去)
较浓a溶液是_______ ,固体b是_______ 。

(1)写出实验室制氯气的离子方程式
(2)结合平衡移动原理,解释饱和食盐水的作用是
(3)已知:不同温度下MnO2与盐酸反应的平衡常数
| 温度t/℃ | 50 | 80 | 110 |
| 平衡常数K | 3.104×10-4 | 2.347×10-3 | 1.293×10-2 |
(4)为探究条件对该反应的影响,小组同学设计并完成以下实验:
| 序号 | 试剂 | 实验操作 | 现象 |
| 实验1 | 4 mol/L盐酸、MnO2 | 加热 | 无明显现象 |
| 实验2 | 7 mol/L浓盐酸、MnO2 | 不加热 | 无明显现象 |
| 实验3 | 7 mol/L浓盐酸、MnO2 | 加热 | 产生黄绿色气体 |
②针对实验1和实验3的现象,小组同学从电极反应角度分析物质氧化性和还原性的变化规律。
写出实验中制氯气反应的电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
提出假设:
ⅰ.增大c(H+),可以
ⅱ.增大c(Cl-),可以增大Cl-的还原性。
③补充实验,实验II、III分别证实了②中的分析。
| 实验序号 | 实验操作 | 试剂 | 产物 |
| I |  | 没有添加新的试剂 | 无氯气生成 |
| II | 较浓a溶液 | 有氯气生成 | |
| III | 固体b | 有氯气生成 |
较浓a溶液是
您最近一年使用:0次
【推荐3】锰的重要用途是制造锰钢。一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如下:
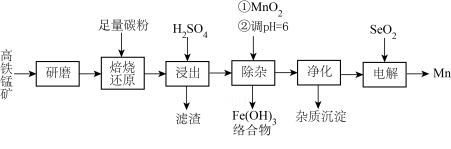
回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有___________ 、___________ (填化学式)。
②根据下表数据,焙烧时应选择的温度为___________ 。
(2)“浸出”产生“滤渣”的主要成分为___________ (填化学式);该步骤中需再加入MnSO4以促进“滤渣"析出,结合化学反应原理解释其原因:___________ 。
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为___________ ;再将pH逐步调至6,Fe3+水解为Fe(OH)3,同时Fe3+与Na+、K+形成络合物沉淀。
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和___________ (填化学式)。
②研究表明,加入适量的SeO2有利于Mn在电极上析出。机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为___________ ,电极上的Se对Mn2+有特殊的吸附性能,使Mn2+的电还原沉积成为主要反应。

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有
②根据下表数据,焙烧时应选择的温度为
| 还原温度/℃ | 焙烧后Mn元素在主要含锰物质中的分布/% | ||
| MnO2 | 高价锰(MnxOy) | 低价锰(MnO) | |
| 600 | 40.92 | 34.76 | 24.32 |
| 800 | 10.56 | 6.63 | 82.81 |
| 1000 | 5.77 | 2.70 | 91.29 |
| 1100 | 痕量 | 0.46 | 98.76 |
| 1200 | 痕量 | 0.30 | 97.94 |
(2)“浸出”产生“滤渣”的主要成分为
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和
②研究表明,加入适量的SeO2有利于Mn在电极上析出。机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
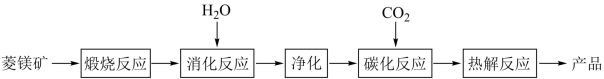
(1)根据下列表格数据,选择消化反应的最佳温度__________ ;理由是___________________________ 。
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________ 。
(3)流程图中__________ 和__________ 可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH 为9.5时,此时Mn2+小于__________ mol·L-1,不会沉淀出来。
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________ 。
A.Ca(ClO)2 B.Cl2
C.H2O2 D.HNO3
③下列方案中,较好的为_________ ,理由是_____________________ 。


(1)根据下列表格数据,选择消化反应的最佳温度
| 消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为
(3)流程图中
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH 为9.5时,此时Mn2+小于
| 物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为
A.Ca(ClO)2 B.Cl2
C.H2O2 D.HNO3
③下列方案中,较好的为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】铬铁矿的要紧成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
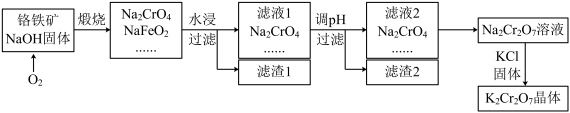
已知:①NaFeO2遇水强烈水解 。
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
请回答:
(1)K2Cr2O7中Cr元素的化合价是___ 。
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是___ 。
(3)滤渣1为红褐色的固体,滤渣1的成分是(填名称 )____ ,滤液1的成分除Na2CrO4、NaOH外,还含有___ (填化学式 )。
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是___ 。
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是___ 。
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、____ 、过滤、洗涤、干燥。

已知:①NaFeO2遇水
②2CrO42-+2H+
 Cr2O72-+H2O
Cr2O72-+H2O请回答:
(1)K2Cr2O7中Cr元素的化合价是
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
(3)滤渣1为红褐色的固体,滤渣1的成分是(填
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。
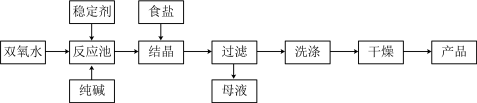
(1)碳酸钠水溶液呈碱性的原因是____________ (用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________ 。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____ (填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________ ,母液中可循环使用的物质是_________ (填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量{[O]= }来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为
}来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________ (用代数式表示)。

(1)碳酸钠水溶液呈碱性的原因是
(2)过碳酸钠受热易分解,写出反应的化学方程式:
(3)稳定剂可能是
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是
(5)工业上常以过碳酸钠产品中活性含氧量{[O]=
 }来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为
}来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为
您最近一年使用:0次



