叠氮化钾(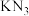 )能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
)能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
I.制备
步骤1:制备亚硝酸丁酯(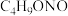 )
)

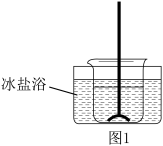
反应装置如图1(夹持装置略去),向烧杯中依次加入稀硫酸、丁醇、亚硝酸钠溶液,待反应完全后,分离出上层油状物,用 和
和 的混合溶液洗涤三次,经干燥后备用。
的混合溶液洗涤三次,经干燥后备用。
步骤2:制备叠氮化钾
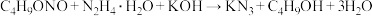
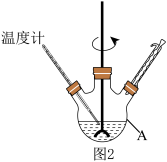
反应装置如图2(夹持及加热装置路去),向仪器A中加入 乙醇溶液、
乙醇溶液、 的联氨(
的联氨( )、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于
)、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于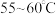 干燥。
干燥。
相关物质性质如下:
请回答:
(1)仪器A的名称为_____________ .
(2)步骤1中分离出亚硝酸丁酯的操作名称为_____________ ;步骤1中用NaCl和NaHCO3的混合溶液洗涤的目的是__________________________ .
(3)步骤2中冰浴冷却的目的是__________________________ ;步骤2中干燥产品的温度控制在55~60℃,原因是__________________________
(4)如需提高产品的纯度,可在_____________ (填编号)中进行重结晶。
A.无水乙醇 B.无水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法测定产品的纯度
原理: 与
与 反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“
反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“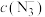 吸光度”曲线确定样品溶液中的
吸光度”曲线确定样品溶液中的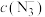 。测定步骤如下:
。测定步骤如下:
①用 晶体配制
晶体配制 标准溶液;
标准溶液;
②配制一组相同体积(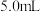 )不同浓度的
)不同浓度的 标准溶液,分别加入
标准溶液,分别加入 (足量)
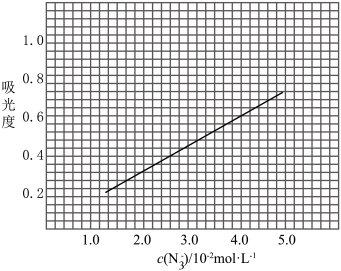
(足量) 标准溶液,摇匀,测量吸光度,绘制标准溶液的
标准溶液,摇匀,测量吸光度,绘制标准溶液的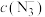 与吸光度的关系曲线,如图;
与吸光度的关系曲线,如图;
③产品测定:称取0.360g产品,配成 溶液,取出
溶液,取出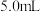 于标准管中,加入
于标准管中,加入 (足量)
(足量) 标准溶液,摇匀,测得吸光度为0.6。
标准溶液,摇匀,测得吸光度为0.6。
(5)实验室用 晶体配制
晶体配制 标准溶液的方法为
标准溶液的方法为_________________ .
(6)产品的纯度为_________________ ;若③中加入的 标准溶液不足以将产品完全反应,则测得的产品纯度
标准溶液不足以将产品完全反应,则测得的产品纯度________________ (填“偏高”“偏低”或“无影响”)。
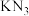 )能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
)能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:I.制备
步骤1:制备亚硝酸丁酯(
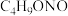 )
)
反应装置如图1(夹持装置略去),向烧杯中依次加入稀硫酸、丁醇、亚硝酸钠溶液,待反应完全后,分离出上层油状物,用
 和
和 的混合溶液洗涤三次,经干燥后备用。
的混合溶液洗涤三次,经干燥后备用。步骤2:制备叠氮化钾
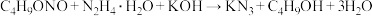
反应装置如图2(夹持及加热装置路去),向仪器A中加入
 乙醇溶液、
乙醇溶液、 的联氨(
的联氨( )、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于
)、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于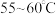 干燥。
干燥。

相关物质性质如下:
| 物质 | 颜色、状态 | 沸点(℃) | 溶解性 |
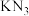 | 无色晶体 | 受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
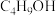 | 无色液体 | 118 | 微溶于水,与乙醇、乙醚混溶 |
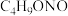 | 无色或淡黄色油状液体 | 78 | 不溶于水,与乙醇、乙醚混溶 |
 | 无色油状液体 | 118 | 与水、乙醇混溶,不溶于乙醚 |
请回答:
(1)仪器A的名称为
(2)步骤1中分离出亚硝酸丁酯的操作名称为
(3)步骤2中冰浴冷却的目的是
(4)如需提高产品的纯度,可在
A.无水乙醇 B.无水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法测定产品的纯度
原理:
 与
与 反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“
反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“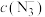 吸光度”曲线确定样品溶液中的
吸光度”曲线确定样品溶液中的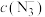 。测定步骤如下:
。测定步骤如下:①用
 晶体配制
晶体配制 标准溶液;
标准溶液;②配制一组相同体积(
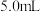 )不同浓度的
)不同浓度的 标准溶液,分别加入
标准溶液,分别加入 (足量)
(足量) 标准溶液,摇匀,测量吸光度,绘制标准溶液的
标准溶液,摇匀,测量吸光度,绘制标准溶液的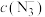 与吸光度的关系曲线,如图;
与吸光度的关系曲线,如图;
③产品测定:称取0.360g产品,配成
 溶液,取出
溶液,取出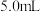 于标准管中,加入
于标准管中,加入 (足量)
(足量) 标准溶液,摇匀,测得吸光度为0.6。
标准溶液,摇匀,测得吸光度为0.6。(5)实验室用
 晶体配制
晶体配制 标准溶液的方法为
标准溶液的方法为(6)产品的纯度为
 标准溶液不足以将产品完全反应,则测得的产品纯度
标准溶液不足以将产品完全反应,则测得的产品纯度
19-20高三上·浙江·开学考试 查看更多[4]
(已下线)浙江省超级全能生2020届高三第一次联考(9月)化学试题广东省深圳市高级中学2020届高三上学期理科综合考试七—化学试题福建省厦门双十中学2020届高三上学期第二次(12月)月考化学试题(已下线)专题十八化学实验综合题解题策略
更新时间:2019-09-24 20:10:47
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
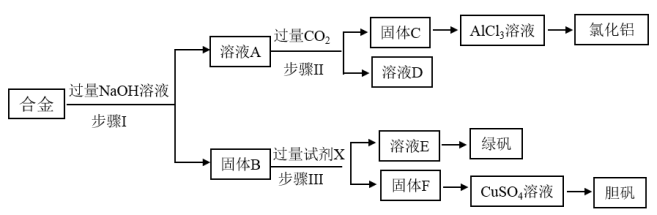
请回答下列问题:
(1)写出步骤Ⅰ反应的离子方程式:___________________________________ 。
(2)试剂X是________ 。
(3)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是__________ ; 操作要用到的玻璃仪器主要有_______ 、_______ 、_______ 。
(4)写出步骤Ⅱ的化学反应方程式:___________________________________ 。
(5)固体F是________ (填化学式);CuSO4溶液经过_________ 、_________ 、过滤、洗涤、烘干等一系列操作得到胆矾。

请回答下列问题:
(1)写出步骤Ⅰ反应的离子方程式:
(2)试剂X是
(3)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是
(4)写出步骤Ⅱ的化学反应方程式:
(5)固体F是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】1781年由瑞典化学家卡尔·威廉·舍耶尔发现白钨矿,并提取出新的元素酸—钨酸,1783年被西班牙人德普尔亚用碳还原三氧化钨第一次得到了钨粉,并命名该元素。我国的白钨矿主要产自江西武宁、湖南汝城等地,其主要成分是CaWO4,含少量Fe2O3和SiO2,如图是利用白钨矿冶炼钨的工艺流程:
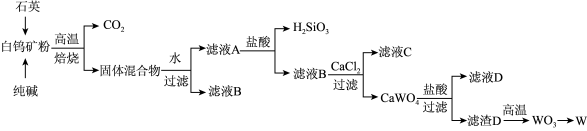
已知:①钨在高温下能与碳反应生成硬质合金碳化钨(WC),其中钨为+4价。
②钨酸(H2WO4)酸性很弱,难溶于水。
回答下列问题:
(1)高温焙烧前,需要将矿石粉碎,其目的是:____ ;高温焙烧时,原料之间除发生CaWO4+Na2CO3 CaCO3+Na2WO4反应外,还发生的反应是
CaCO3+Na2WO4反应外,还发生的反应是____ 。
(2)滤渣A的主要成分是____ ,向滤液A中加入盐酸调pH时,pH太低会导致钨的产率降低,其原因是___ 。
(3)若用等物质的量的CO、H2、Al作还原剂还原WO3冶炼W,理论上可得到的W的质量之比是____ 。
(4)已知Ca(OH)2和CaWO4的沉淀溶解平衡曲线如图甲所示。一定温度下,向Na2WO4溶液中加入石灰乳可以得到大量的CaWO4,该反应的平衡常数值K=____ 。

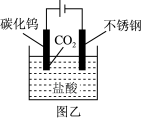
(5)利用电解法能从碳化钨废料中回收钨,电解装置如图乙,阳极析出滤渣D,写出阳极的电极反应____ 。

已知:①钨在高温下能与碳反应生成硬质合金碳化钨(WC),其中钨为+4价。
②钨酸(H2WO4)酸性很弱,难溶于水。
回答下列问题:
(1)高温焙烧前,需要将矿石粉碎,其目的是:
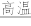 CaCO3+Na2WO4反应外,还发生的反应是
CaCO3+Na2WO4反应外,还发生的反应是(2)滤渣A的主要成分是
(3)若用等物质的量的CO、H2、Al作还原剂还原WO3冶炼W,理论上可得到的W的质量之比是
(4)已知Ca(OH)2和CaWO4的沉淀溶解平衡曲线如图甲所示。一定温度下,向Na2WO4溶液中加入石灰乳可以得到大量的CaWO4,该反应的平衡常数值K=

(5)利用电解法能从碳化钨废料中回收钨,电解装置如图乙,阳极析出滤渣D,写出阳极的电极反应

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】硫酸亚铁晶体(FeSO4•7H2O)是医药上补血剂的有效成分。某课外小组测定该补血剂中铁元素含量的流程如下(已知其它成分在测定过程中不参与反应),回答下列问题:
(1)步骤①研细的目的是_______ 。
(2)证明步骤②滤液中含有Fe2+的方法是_______ 。
(3)步骤③加入H2O2的目的_______ ,发生反应的离子方程式是_______ 。
(4)步骤③后过量X溶液是_______ (填化学式)溶液。
(5)步骤④中一系列操作依次是_______ 、洗涤、灼烧、冷却、称量。
(6)假设实验无损耗,正常人每天应补充16.8mg左右的铁,如果全部通过服用上述测定的补血剂片来补充,则正常人每天需服用上述补血剂_______ 片。

(1)步骤①研细的目的是
(2)证明步骤②滤液中含有Fe2+的方法是
(3)步骤③加入H2O2的目的
(4)步骤③后过量X溶液是
(5)步骤④中一系列操作依次是
(6)假设实验无损耗,正常人每天应补充16.8mg左右的铁,如果全部通过服用上述测定的补血剂片来补充,则正常人每天需服用上述补血剂
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
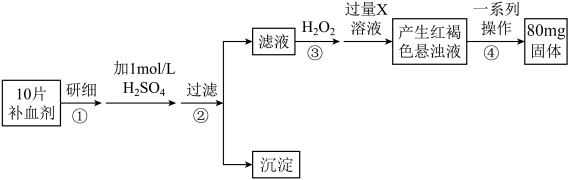
【推荐1】(一)含硫物质燃烧会产生大量烟气(主要成分是SO2,CO2,N2,O2)。某研究小组在实验室利用如图装置制备模拟烟气,并侧定烟气中SO2的体积分数以及研究烟气通过转化器的脱硫效率。
I.模拟烟气的制备
(1)A装置中发生反应的化学方程式为_______ 。将A中产生的气体与空气一起通过B装置混合均匀,从而获得模拟烟气用于后续实验。
Ⅱ.测定烟气中的体积分数
(2)将部分模拟烟气缓慢通过C,D装置,其中C、D中盛有的药品分别是_______ 。(填序号)。
①酸性KMnO4溶液 ②饱和 NaHSO3溶液 ③饱和 Na2CO3溶液 ④饱和 NaHCO3溶液
C装置中可观察到的现象是_______
(3)甲同学认为测定烟SO2的体积分数的装置中存在缺陷,应进行的改进措施是_______
(二)铝热反应如图

(4)镁条的作用_______
(5)KClO3的作用_______
(6)镁条引燃后发生反应的化学方程式_______

I.模拟烟气的制备
(1)A装置中发生反应的化学方程式为
Ⅱ.测定烟气中的体积分数
(2)将部分模拟烟气缓慢通过C,D装置,其中C、D中盛有的药品分别是
①酸性KMnO4溶液 ②饱和 NaHSO3溶液 ③饱和 Na2CO3溶液 ④饱和 NaHCO3溶液
C装置中可观察到的现象是
(3)甲同学认为测定烟SO2的体积分数的装置中存在缺陷,应进行的改进措施是
(二)铝热反应如图

(4)镁条的作用
(5)KClO3的作用
(6)镁条引燃后发生反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
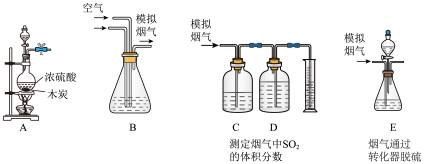
【推荐2】为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
实验步骤及现象如下:
①查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向A中烧瓶中缓慢滴加浓盐酸,剧烈反应,有黄绿色气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有___ (填化学式)生成。实验中,在打开浓盐酸试剂瓶时看到瓶口有“白雾”冒出,该“白雾”的化学成分是___ 。
(2)1molNa2O2所含的阴阳离子的总物质的量是__ mol。装置C的作用是__ 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①___ ;②___ 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
__ Na2O2+__ HCl=___ Cl2+__ NaCl+__
该反应__ (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是___ (要求答出一点即可)。
(5)实验室用二氧化锰和浓盐酸制备氯气的离子反应方程式为:__ 。

实验步骤及现象如下:
①查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向A中烧瓶中缓慢滴加浓盐酸,剧烈反应,有黄绿色气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有
(2)1molNa2O2所含的阴阳离子的总物质的量是
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
该反应
(5)实验室用二氧化锰和浓盐酸制备氯气的离子反应方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】碱式碳酸镁是制备金属镁及其化合物的原料,以卤块(主要成分为MgCl2,此外还含有Fe3+、Fe2+等离子)为原料制备碱式碳酸镁[MgCO3·Mg(OH)2]的工艺流程如下:
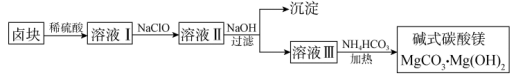
回答下列问题:
(1)HClO的电子式为_______ 。
(2)溶液I中加入NaClO反应的离子方程式为_______ 。
(3)向溶液II中加入NaOH的目的是_______ 。
(4)由溶液III制备碱式碳酸镁时加热温度不宜过高,原因是_______ ,生成碱式碳酸镁反应的离子方程式为_______ 。
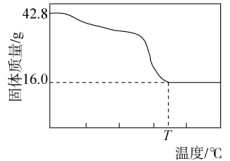
(5)采用上述流程制得的碱式碳酸镁常含一定量结晶水,化学式为MgCO3·Mg(OH)2·xH2O。称取42.8 g样品,进行热重分析,并绘制出如图所示热重曲线示意图。已知T℃时固体样品为MgO,计算x=_______
(6)写出用惰性电极电解MgCl2溶液化学反应方程式_______ 。

回答下列问题:
(1)HClO的电子式为
(2)溶液I中加入NaClO反应的离子方程式为
(3)向溶液II中加入NaOH的目的是
(4)由溶液III制备碱式碳酸镁时加热温度不宜过高,原因是
(5)采用上述流程制得的碱式碳酸镁常含一定量结晶水,化学式为MgCO3·Mg(OH)2·xH2O。称取42.8 g样品,进行热重分析,并绘制出如图所示热重曲线示意图。已知T℃时固体样品为MgO,计算x=

(6)写出用惰性电极电解MgCl2溶液化学反应方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
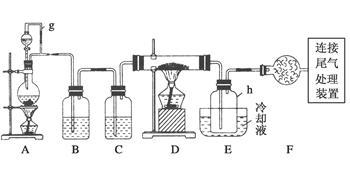
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________________ 。
(2)装置A中g管的作用是________ ;装置C中的试剂是________ ;装置E中的h瓶需要冷却的理由是__________________________________ ;
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________ (填写元素符号)。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式
(2)装置A中g管的作用是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】一氧化二氯(Cl2O)可用作氯化剂,其部分性质如下:
实验室制备原理: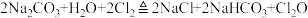 。现用如图所示装置设计实验制备少量Cl2O,并探究相关物质的性质。
。现用如图所示装置设计实验制备少量Cl2O,并探究相关物质的性质。
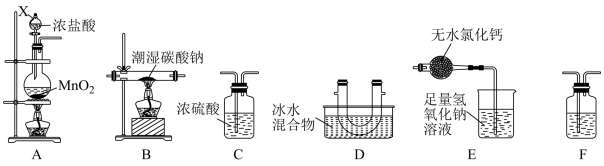
(1)装置A中仪器X的名称为_______ 。
(2)若气体从左至右流动,则装置的连接顺序是A、_______ (每个装置限用一次)。
(3)装置F中盛装试剂的名称为_______ 。装置E中无水氯化钙的作用_______ 。
(4)装置A中发生反应的离子方程式为_______ 。
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:_______
(6)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E的化学方程式_______ 。
| 物理性质 | 化学性质 |
| 常温下,Cl2O是棕黄色有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ | Cl2O不稳定,接触一般有机物易爆炸;它易溶于水,同时反应生成次氯酸 |
 。现用如图所示装置设计实验制备少量Cl2O,并探究相关物质的性质。
。现用如图所示装置设计实验制备少量Cl2O,并探究相关物质的性质。
(1)装置A中仪器X的名称为
(2)若气体从左至右流动,则装置的连接顺序是A、
(3)装置F中盛装试剂的名称为
(4)装置A中发生反应的离子方程式为
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:
(6)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室以 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示:
②
③ 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于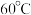 时,
时, 发生分解生成
发生分解生成 和
和 。
。
(1)反应1中 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为___________ 。
(2)在图1所示装置中发生反应2生成 ,反应过程中放出大量的热。
,反应过程中放出大量的热。 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是___________ 。
②装置Ⅱ的作用是___________ 。
(3)反应结束后,为从母液2中获得 晶体,需进行以下操作:
晶体,需进行以下操作:
①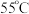 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用___________  热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。
(4) 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:___________ ,用无水乙醇洗涤,干燥得到产品。
(可选用的试剂: 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)
 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示: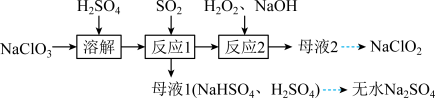

②
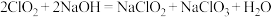
③
 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于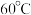 时,
时, 发生分解生成
发生分解生成 和
和 。
。(1)反应1中
 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为(2)在图1所示装置中发生反应2生成
 ,反应过程中放出大量的热。
,反应过程中放出大量的热。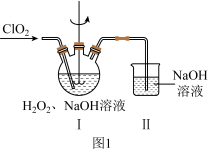
 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是②装置Ⅱ的作用是
(3)反应结束后,为从母液2中获得
 晶体,需进行以下操作:
晶体,需进行以下操作:①
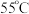 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用 热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。(4)
 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:(可选用的试剂:
 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)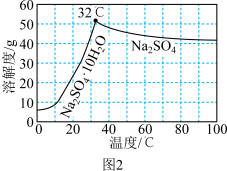
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】生铁中含碳和硫等元素。化学兴趣小组对某生铁样品成分及其含量进行探究。
I.生铁中碳和硫元素的定性检验
(1)将以下装置进行连接以完成实验(夹持仪器已略去,填接口字母代号)

a→( ) →( ) →( ) →( ) →( ) →( ) →( )
(2)将样品研磨成粉末的目的是______________________ 。
(3)确认样品中含有碳元素的现象是_________________________ 。
II.生铁中碳、硫质量分数的测定
(4)甲同学认为,以上装置可以粗略测定样品中碳的含量。称取样品m1g进行实验,
充分反应后,测得C中生成的沉淀为m2g,该样品中碳的质量分数不小于___________ (用含m1、m2的式子表示)
(5)乙同学认为,待一定量样品充分反应后,向E装置中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案是否合理?________ (填“是”或“否”);说明理由_______________ 。
(6)丙同学提议:为测定样品中硫的含量,可将c装置中试剂改为足量的30%双氧水,并按A→C→B→C装置连接进行实验,充分反应后,请你简述后续的实验方案___________ 。
I.生铁中碳和硫元素的定性检验
(1)将以下装置进行连接以完成实验(夹持仪器已略去,填接口字母代号)

a→
(2)将样品研磨成粉末的目的是
(3)确认样品中含有碳元素的现象是
II.生铁中碳、硫质量分数的测定
(4)甲同学认为,以上装置可以粗略测定样品中碳的含量。称取样品m1g进行实验,
充分反应后,测得C中生成的沉淀为m2g,该样品中碳的质量分数不小于
(5)乙同学认为,待一定量样品充分反应后,向E装置中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案是否合理?
(6)丙同学提议:为测定样品中硫的含量,可将c装置中试剂改为足量的30%双氧水,并按A→C→B→C装置连接进行实验,充分反应后,请你简述后续的实验方案
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】过氧化氢与尿素通过氢键形成加合物[CO(NH2)2·H2O2],这是一种高效、安全的固态过氧化氢形式,既解决了储藏运输等困难,也提高了高活性高含量氧在水溶液中的稳定性。
Ⅰ.加合物的制备
量取6.8mL30%H2O2溶液放于反应容器中,再加入2.4g尿素。控制60℃下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温。晶体置于滤纸上几分钟,称重记录3.6g。
(1)制备时,加入过氧化氢略过量,其目的是_______ 。
(2)控制温度60℃左右所采用的加热方式是_______ ,过程中监测温度的方法为_______ ;制备时的反应容器是一种便于结晶的陶瓷仪器,该仪器为下列_______ (填序号)。
A.圆底蒸发皿 B.坩埚
B.坩埚 C.烧杯
C.烧杯 D.瓷制研钵
D.瓷制研钵
(3)尿素中常含有少量铁、铜等离子杂质,需加入稳定剂以提高加合物的产率。不加稳定剂时,铁、铜等离子导致产品稳定性以及产率降低的可能原因是_______ 。
Ⅱ.产品纯度测定
实验步骤:填写下述测定步骤中的空白。
(4)取ag产品至50mL烧杯中,_______ ,将溶液转移至100mL容量瓶中定容并摇匀。吸取10.0mL溶液于_______ 中,加入100mL水和20mL10%硫酸,用cmol/LKMnO4溶液(不与尿素反应)滴定至粉红色,30s不褪色。共重复平行测定三次,平均消耗bmLKMnO4溶液。
数据分析:
(5)酸性KMnO4溶液滴定H2O2时,氧化剂与还原剂的物质的量之比为_______ ,据此计算产品的纯度为_______ %。
Ⅰ.加合物的制备
量取6.8mL30%H2O2溶液放于反应容器中,再加入2.4g尿素。控制60℃下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温。晶体置于滤纸上几分钟,称重记录3.6g。
(1)制备时,加入过氧化氢略过量,其目的是
(2)控制温度60℃左右所采用的加热方式是
A.圆底蒸发皿
 B.坩埚
B.坩埚 C.烧杯
C.烧杯 D.瓷制研钵
D.瓷制研钵
(3)尿素中常含有少量铁、铜等离子杂质,需加入稳定剂以提高加合物的产率。不加稳定剂时,铁、铜等离子导致产品稳定性以及产率降低的可能原因是
Ⅱ.产品纯度测定
实验步骤:填写下述测定步骤中的空白。
(4)取ag产品至50mL烧杯中,
数据分析:
(5)酸性KMnO4溶液滴定H2O2时,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
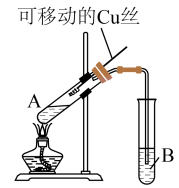
(1)提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
(2)设计实验:
实验前,试管B中盛放的是__________ (填“品红”或“酚酞”)溶液。
(3)实验结论:通过以上实验,说明浓硫酸具有__________ (填字母代号)。
A.强氧化性 B.脱水性 C.吸水性
(4)问题与讨论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是__________ (填化学式);他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________ (填字母代号)。
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0 g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4 g,将试管A中液体稀释成100 mL溶液。该溶液中Cu2+的物质的量浓度为__________ mol·L-1。

(1)提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
(2)设计实验:
| 实验编号 | 实验操作 | 实验现象 |
| 1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
| 2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
(3)实验结论:通过以上实验,说明浓硫酸具有
A.强氧化性 B.脱水性 C.吸水性
(4)问题与讨论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0 g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4 g,将试管A中液体稀释成100 mL溶液。该溶液中Cu2+的物质的量浓度为
您最近一年使用:0次



