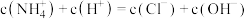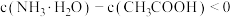下列说法中正确的是( )
A.已知0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+,加少量烧碱溶液可使溶液 CH3COO-+H+,加少量烧碱溶液可使溶液 增大 增大 |
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 H++OH-逆向移动,c(H+)降低 |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释后,溶液中 不变 不变 |
| D.0.1 mol·L-1的醋酸加水稀释后,溶液中所有离子的浓度均减小 |
更新时间:2019-11-27 17:22:41
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】乙二胺(H2NCH2CH2NH2),无色液体,有类似于氨的性质 ,已知:25℃时,电离常数kb1=10-4.07 kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误 的是

A.H2NCH2CH2NH2在水溶液中第一步电离的方程式H2NCH2CH2NH2+H2O H2NCH2CH2NH3++OH- H2NCH2CH2NH3++OH- |
| B.曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+ |
| C.曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07 |
| D.在0.1 mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列有关说法正确的是
A.一定条件下反应N2+3H2 2NH3,达到平衡时,3v正(H2)=2v正(NH3) 2NH3,达到平衡时,3v正(H2)=2v正(NH3) |
| B.25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸 |
| C.将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 |
| D.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列叙述不正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液 时, 时,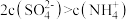 |
B.两种 溶液的物质的量浓度分别为 溶液的物质的量浓度分别为 和 和 , , 分别为a和 分别为a和 ,则 ,则 |
C. 的 的 溶液与 溶液与 的 的 溶液等体积混合,滴入石蕊溶液呈红色 溶液等体积混合,滴入石蕊溶液呈红色 |
D.向 的氨水中加入少量硫酸铵固体,则溶液中 的氨水中加入少量硫酸铵固体,则溶液中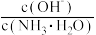 减小 减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
 CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是| A.溶液PH等于1 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)降低 |
| D.加入少量CH3COONa固体,平衡向左移动,导电能力不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】取未知浓度的硫酸、盐酸和醋酸各25.00 mL,分别用0.10 mol·L-1的NaOH溶液或0.10 mol·L-1的稀氨水滴定得如图所示结果。下列说法不正确的是


| A.由图可知曲线a为NaOH溶液滴定醋酸 |
| B.曲线b的滴定实验可用酚酞作指示剂 |
| C.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 |
| D.由图可知滴定前醋酸的电离度约为1.67% |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃,某混合溶液中c(A-)+c(HA)=0.01mol/L,改变溶液的pH,1gc(HA)、1gc(A-)、lgc(H+)和1gc(OH-)随pH变化的关系如图所示。Ka为HA的电离常数。
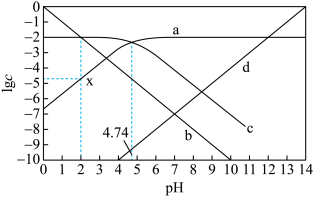
下列叙述错误的是

下列叙述错误的是
| A.pH=10时,c(A-)﹥c(OH-)﹥c(HA) |
| B.0.01mol/LNaA溶液的pH约等于线c与线d交点处的横坐标值 |
| C.pH由7到14的变化过程中,A-的水解程度始终增大 |
| D.HA电离常数的数量级为10-5,图中点x的纵坐标值为-4.74 |
您最近一年使用:0次

 增大
增大
 CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是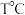 ,
, 和
和 的电离平衡常数均约为
的电离平衡常数均约为 。向
。向 浓度均为
浓度均为 的盐酸和醋酸的混合溶液中逐滴加入
的盐酸和醋酸的混合溶液中逐滴加入
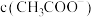 约为
约为