现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍,M原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________ (用元素符号表示)。
(2)基态M原子的核外电子排布式为__________________________ 。
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为____________ ,W原子的杂化类型为____________ 。
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为__________________________ (用化学式表示)。
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:
(2)基态M原子的核外电子排布式为
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为
2019高三·全国·专题练习 查看更多[3]
(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测湖北宜城市第二中学2019-2020学年高二下学期期中考试化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》
更新时间:2019-12-04 06:42:38
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)元素的第一电离能:N________ O(填“>”或“<”)。
(2)基态Fe2+的电子排布式为___________________________________________________ 。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
则该元素的元素符号是________ 。
(4)NO 的空间构型
的空间构型______________________________ (用文字描述),SO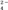 中硫原子的杂化方式为
中硫原子的杂化方式为________________________ 。
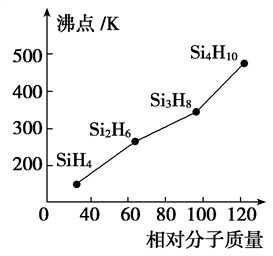
(5)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_________________________________________________ 。
(6)金属铜原子的堆积方式为面心立方最密堆积,铜的原子半径为r nm,则铜晶胞的体积表达式为________ cm3。
(2)基态Fe2+的电子排布式为
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| In/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 575 | … |
则该元素的元素符号是
(4)NO
 的空间构型
的空间构型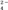 中硫原子的杂化方式为
中硫原子的杂化方式为(5)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是

(6)金属铜原子的堆积方式为面心立方最密堆积,铜的原子半径为r nm,则铜晶胞的体积表达式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】I.水溶液是中学化学的重点研究对象。
(1)常温下,向amol·L-1CH3COONa溶液中滴加等体积的bmol·L-1盐酸化溶液呈中性(不考虑盐酸和醋酸的挥发),则醋酸的电离常数Ka=____ (用含a和b的代数式表示)。
(2)次磷酸(H3PO2)是一种精细化工产品,已知10mL1mol·L-1H3PO2与20mL1mol·L-1的NaOH溶液充分反应后生成组成为NaH2PO2的盐,回答下列问题:
①NaH2PO2属于____ (填“正盐”“酸式盐”或“无法确定”)。
②若25℃时,K(H3PO2)=1×10-2,则0.02mol·L-1的H3PO2溶液的pH=____ 。
③设计两种实验方案,证明次磷酸是弱酸:____ 、____ 。
(3)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:____ 。
②b点时溶液中c(H2N2O2)___ c(N2O )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
③c点时溶液中各离子浓度由大到小的顺序为____ 。
(4)II.M是第4周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,M元素基态原子的核外电子排布式为____ 。
(1)常温下,向amol·L-1CH3COONa溶液中滴加等体积的bmol·L-1盐酸化溶液呈中性(不考虑盐酸和醋酸的挥发),则醋酸的电离常数Ka=
(2)次磷酸(H3PO2)是一种精细化工产品,已知10mL1mol·L-1H3PO2与20mL1mol·L-1的NaOH溶液充分反应后生成组成为NaH2PO2的盐,回答下列问题:
①NaH2PO2属于
②若25℃时,K(H3PO2)=1×10-2,则0.02mol·L-1的H3PO2溶液的pH=
③设计两种实验方案,证明次磷酸是弱酸:
(3)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②b点时溶液中c(H2N2O2)
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。③c点时溶液中各离子浓度由大到小的顺序为
(4)II.M是第4周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,M元素基态原子的核外电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题:
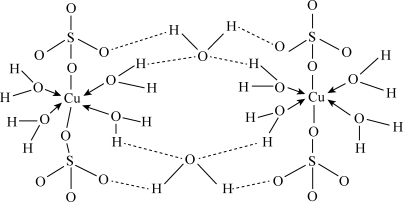
(1)基态铜原子的价层电子排布式为_______ ,位于周期表中第_______ 周期_______ 族。
(2)胆矾中S原子的杂化方式是_______ ,H、O、S中,第一电离能最大的元素是_______ (填元素符号)
(3)胆矾中存在的化学键有配位键、_______ 。
(4)含硫化合物SOCl2的VSEPR模型是_______ ,试分析该分子中键角∠Cl-S-O大于∠Cl-S-Cl的原因是_______ 。
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有_______ 个铜原子,铜原子的半径为rcm,则铜晶体的密度为_______ g·cm-3(阿伏加德罗常数值用NA表示)。

(1)基态铜原子的价层电子排布式为
(2)胆矾中S原子的杂化方式是
(3)胆矾中存在的化学键有配位键、
(4)含硫化合物SOCl2的VSEPR模型是
(5)立方铜晶胞中铜原子的配位数为12,则每个晶胞中有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1) A元素在元素周期表中的位置________ ;A、B、C三种元素的第一电离能由大到小的排序为_____ (用元素符号填写);
(2) B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为____ ,B元素所形成的单质分子中σ键与π键数目之比为____ 。
(3) G元素的低价阳离子的离子结构示意图是________ ,F元素原子的外围电子排布图是________ ,H元素的基态原子核外电子排布式是________ 。
(4) D元素的单质及其常见化合物的焰色反应主要利用了原子光谱中的______ (A.原子吸收光谱B.原子发射光谱)
(5) 上述元素属于p区的是_______ (用元素符号填写);
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1) A元素在元素周期表中的位置
(2) B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为
(3) G元素的低价阳离子的离子结构示意图是
(4) D元素的单质及其常见化合物的焰色反应主要利用了原子光谱中的
(5) 上述元素属于p区的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E、F、G为前四周期元素。A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子。
(1)元素B、C、D的第一电离能由大到小的顺序为____________ (用元素符号表示)。
(2)ED3分子的空间构型为________ ,中心原子的杂化方式为________________________ 。
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是__________ (填序号)。
(4)CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是________ (填序号)。
a.微粒的空间构型b.C原子的杂化类型
c.A-C-A的键角d.微粒的电子数
(5)EBC-的等电子体中属于分子的有____________ (填化学式),EBC-的电子式为____________ 。
(6)G的价层电子排布式为________ ,化合物[G(CA3)6]F3的中心离子的配位数为______________ 。
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:
①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为_____________ 。
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为_____________ g.cm-3。

(1)元素B、C、D的第一电离能由大到小的顺序为
(2)ED3分子的空间构型为
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是
(4)CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是
a.微粒的空间构型b.C原子的杂化类型
c.A-C-A的键角d.微粒的电子数
(5)EBC-的等电子体中属于分子的有
(6)G的价层电子排布式为
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:
①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】铁与镁组成的合金是目前已发现的储氢密度最高的储氢材料之一,回答下列问题:
(1)下列铁的外围电子排布图中,再失去一个电子需要能量最大的是_______ (填字母)。
A. B.
B.
C.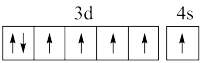 D.
D.
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为_______ (填元素符号)。
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
①(H2NCH2COO)2Fe中含有的非金属元素的第一电离能由大到小的顺序为_______ (用元素符号表示),碳原子的杂化类型为_______ 。
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃的沸点大很多,原因是_______ 。
③原子中的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为_______ 。
④硫酸亚铁(FeSO4)可用于制造甘氨酸亚铁, 的空间构型为
的空间构型为_______ 、形成的σ键的类型为_______ 。
(1)下列铁的外围电子排布图中,再失去一个电子需要能量最大的是
A.
 B.
B.
C.
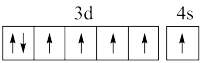 D.
D.
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。
①(H2NCH2COO)2Fe中含有的非金属元素的第一电离能由大到小的顺序为
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃的沸点大很多,原因是
③原子中的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为④硫酸亚铁(FeSO4)可用于制造甘氨酸亚铁,
 的空间构型为
的空间构型为
您最近一年使用:0次



