(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O(l),放出19.5 kJ热量(25 ℃时),表示N2H4燃烧的热化学方程式是____________________________ 。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:__________________________________ 。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________________ 。
(4)下图是一定量丙烷完全燃烧生成CO2和1mol H2O (l)过程中的能量变化图。
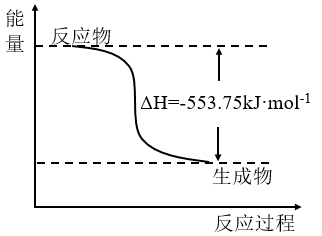
写出表示丙烷燃烧热的热化学方程式:__________________________________ 。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(4)下图是一定量丙烷完全燃烧生成CO2和1mol H2O (l)过程中的能量变化图。

写出表示丙烷燃烧热的热化学方程式:
更新时间:2019/12/24 15:34:53
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
【推荐1】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量,该反应的热化学方程式为_______ ;该反应在_______ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g),如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是在不同温度下CO的转化率随时间变化的曲线。_______ T2(填“>”、“<”或“=”),T1和T2温度下的平衡常数大小关系是K1_______ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是_______ (填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示,则图中t2时采取的措施可能是_______ ;_______ 。
④在toC时,往一密闭4L容器中通入CO和H2各2mol,40min达平衡时测得容器内的总物质的量为2.4mol,则该温度下的平衡常数K=_______ 。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流,负极加入的物质是_______ ,正极的电极反应式为_______ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量,该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g),如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是在不同温度下CO的转化率随时间变化的曲线。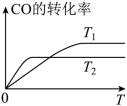
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示,则图中t2时采取的措施可能是
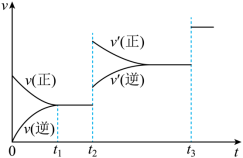
④在toC时,往一密闭4L容器中通入CO和H2各2mol,40min达平衡时测得容器内的总物质的量为2.4mol,则该温度下的平衡常数K=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流,负极加入的物质是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】已知在某温度下2L的密闭容器中进行合成氨的反应,测得如表数据:
根据表中数据计算:
(1)若反应进行到2h时放出的热量为27.78 kJ,试写出该反应的热化学方程式___________
(2)0~1h内N2的平均反应速率为___________ mol•L﹣1•h﹣1。
(3)此温度下该反应第___________ 小时达到平衡,试计算达到平衡时N2的浓度___________ mol•L﹣1
(4)下图能正确表示该反应中能量变化的是___________ (填“A”或“B”)。
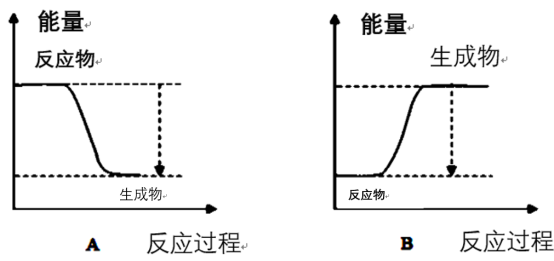
(5)下列说法能说明该反应达到平衡状态的是___________ 。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的物质的量不变
e.容器内的气体密度不变
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
根据表中数据计算:
(1)若反应进行到2h时放出的热量为27.78 kJ,试写出该反应的热化学方程式
(2)0~1h内N2的平均反应速率为
(3)此温度下该反应第
(4)下图能正确表示该反应中能量变化的是

(5)下列说法能说明该反应达到平衡状态的是
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的物质的量不变
e.容器内的气体密度不变
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】汽车尾气中含有CO、NO等有害气体。
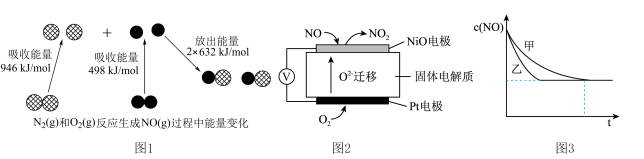
(1)汽车尾气中NO生成过程的能量变化示意图如图1。该条件下,1molN2和1molO2完全反应生成NO会_______________ (填“吸收”或“放出”)___________ kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是___________ 反应(填“氧化”或“还原”)。
②Pt电极上的电极反应式为_______________________________ 。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
①请表中数据补充完整:a___________ ;b____________ 。
②能验证温度对化学反应速率规律的是实验____________________ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线________________ (填“甲”或“乙”)。

(1)汽车尾气中NO生成过程的能量变化示意图如图1。该条件下,1molN2和1molO2完全反应生成NO会
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是
②Pt电极上的电极反应式为
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO
 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。| 实验编号 | t(℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
| Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请表中数据补充完整:a
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线
您最近一年使用:0次
【推荐1】回答下列问题
I:
(1) 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为___________ 。
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(2)利用反应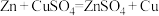 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为___________ ,若开始时两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
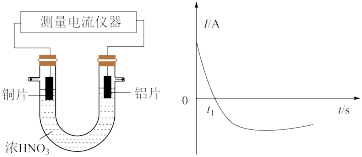
(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中 时刻之前,正极反应式为
时刻之前,正极反应式为___________ , 时刻之后,Cu电极是
时刻之后,Cu电极是___________ (填“正极”或“负极”)。据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
III.现在容积为2L的恒温密闭容器中,充入 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
(4)下列说法正确的是___________ 。
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使 全部转化为
全部转化为
(5)达平衡时, 的转化率为
的转化率为___________ 。
I:
(1)
 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(2)利用反应
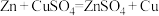 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中
 时刻之前,正极反应式为
时刻之前,正极反应式为 时刻之后,Cu电极是
时刻之后,Cu电极是III.现在容积为2L的恒温密闭容器中,充入
 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
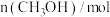 | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
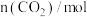 | 1 | 0.50 | 0.35 | A | 0.25 |
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使
 全部转化为
全部转化为
(5)达平衡时,
 的转化率为
的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】现代社会生活离不开能量。
(1)天然气的主要成分是甲烷,它是一种清洁能源。1g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.6kJ的热量,写出该反应的热化学方程式___________ 。
(2)Fe-Cu原电池的装置如图所示,请按要求填空。
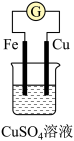
①正极材料是___________ ,溶液中的 向
向___________ (填“铁”或“铜”)电极方向移动。
②负极的现象___________ ,负极的电极反应式___________ 。
③电路中每转移0.2mol电子,析出铜___________ g。
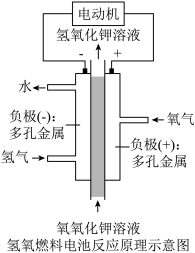
(3)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。该电池负极的电极反应式为___________ ,正极附近溶液碱性___________ (填“增强”或“减弱”)。
(1)天然气的主要成分是甲烷,它是一种清洁能源。1g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.6kJ的热量,写出该反应的热化学方程式
(2)Fe-Cu原电池的装置如图所示,请按要求填空。

①正极材料是
 向
向②负极的现象
③电路中每转移0.2mol电子,析出铜
(3)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。该电池负极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是___ 。
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④固体NaOH溶于水;⑤液态水变成水蒸气;⑥碳高温条件下还原CO2。
(2)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧热的热化学方程式:___ ;
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
则ΔH3与ΔH1、ΔH2与之间的关系为ΔH3=___ ;
(4)已知反应N2(g)+3H2(g) 2NH3(g)ΔH=akJ/mol,试根据表中所列键能数据估算a的值
2NH3(g)ΔH=akJ/mol,试根据表中所列键能数据估算a的值___ 。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释;②酸碱中和反应;③H2在Cl2中燃烧;④固体NaOH溶于水;⑤液态水变成水蒸气;⑥碳高温条件下还原CO2。
(2)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧热的热化学方程式:
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3则ΔH3与ΔH1、ΔH2与之间的关系为ΔH3=
(4)已知反应N2(g)+3H2(g)
 2NH3(g)ΔH=akJ/mol,试根据表中所列键能数据估算a的值
2NH3(g)ΔH=akJ/mol,试根据表中所列键能数据估算a的值| 化学键 | H﹣H | N﹣H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】水溶液中的离子平衡是中学学习的一个重要内容。
(1)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈-1价;SOCl2遇水可生成SO2。蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2∙6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的方程式和必要的文字描述解释原因______________ 。
(2)为应对石油短缺,一碳化学研究备受关注。一碳化学是指以分子中只含一个碳原子的化合物如甲醇、一氧化碳等为原料,制造产品的化学体系的总称。
CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
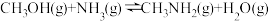
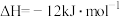
已知该反应中相关的化学键键能数据如下:
则H—O键的键能为______ kJ∙mol−1 (用含有字母的代数式表示)
(3)甲醇在工业上可利用水煤气来合成: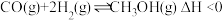 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:
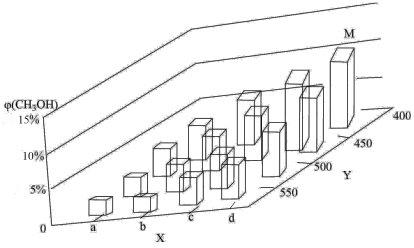
图中Y轴表示的外界条件为___________ ,判断的理由是_________________ 。
(4)25℃时,A酸溶液的pH=a,B碱溶液的pH=b。若A为强酸,B为强碱,且a+b=14,则二者等体积混合后,溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____________ 。若A的化学式为HR,B的化学式为MOH,且a+b=14,二者等体积混合后溶液显酸性,混合后的溶液中,下列微粒浓度大小关系一定正确的是_____ 填序号)。
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)+c(H+)=c(R-)+c(OH-)
⑤c(M+)>c(R-)>c(OH-)>c(H+)
(1)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈-1价;SOCl2遇水可生成SO2。蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2∙6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的方程式和必要的文字描述解释原因
(2)为应对石油短缺,一碳化学研究备受关注。一碳化学是指以分子中只含一个碳原子的化合物如甲醇、一氧化碳等为原料,制造产品的化学体系的总称。
CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
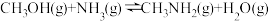
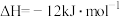
已知该反应中相关的化学键键能数据如下:
| 共价键 | C—N | N—H | C—O | C—H |
| E/(kJ∙mol−1) | a | b | c | d |
(3)甲醇在工业上可利用水煤气来合成:
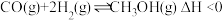 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数 (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:
图中Y轴表示的外界条件为
(4)25℃时,A酸溶液的pH=a,B碱溶液的pH=b。若A为强酸,B为强碱,且a+b=14,则二者等体积混合后,溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)+c(H+)=c(R-)+c(OH-)
⑤c(M+)>c(R-)>c(OH-)>c(H+)
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】按要求完成下列问题。
(1)①甲烷可用于生产合成气,反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+206.4kJ/mol,已知几种物质中化学键的键能如下表所示:则a=_______ 。
②甲醇的燃烧热(25℃,101kPa)为-726.5kJ/mol,请写出甲醇在氧气中完全燃烧的热化学方程式____ 。
(2)①T0温度下,向2L真空密闭容器中加入N2O3固体,发生反应N2O3(s) ⇌NO2(g)+X(g)(未配平),反应过程如图,0-3min内,用NO2表示的反应速率为_______ 。_______ 。
A.X可能为N2
B.当容器内气体平均摩尔质量不变时,可以判断该反应达到平衡
C.第4min时,保持T和V不变,向容器中再加入N2O3,正反应速率加快
(3)近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+和水分子通过。其工作原理的示意图如图,请回答下列问题:_______ (填“正”或“负")极。电解质溶液中的H+向_______ (填“a”、b”)极移动
②该电池通入甲醇一极的电极反应式为_______ 。
(1)①甲烷可用于生产合成气,反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+206.4kJ/mol,已知几种物质中化学键的键能如下表所示:则a=
| 化学键 | H-H | O-H | C-H | C≡O |
| 键能/(kJ/mo) | 436 | 465 | a | 1076 |
(2)①T0温度下,向2L真空密闭容器中加入N2O3固体,发生反应N2O3(s) ⇌NO2(g)+X(g)(未配平),反应过程如图,0-3min内,用NO2表示的反应速率为
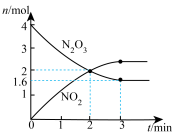
A.X可能为N2
B.当容器内气体平均摩尔质量不变时,可以判断该反应达到平衡
C.第4min时,保持T和V不变,向容器中再加入N2O3,正反应速率加快
(3)近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+和水分子通过。其工作原理的示意图如图,请回答下列问题:
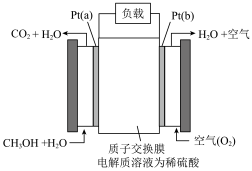
②该电池通入甲醇一极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】氢能是一种极具发展潜力的清洁能源。
(1)氢能是一种既高效又干净的新能源,发展前景良好,用氢能作能源的燃料电池汽车是研究的重点方向之一、下列说法正确的是___________(填字母)。
(2)氢能是一种极具发展潜力的清洁能源,图中是一种以太阳能为热源,高效无污染的制氢方法。
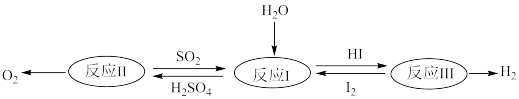
该过程实现了太阳能向_____ 能的转化,反应I的化学方程式为______ 。
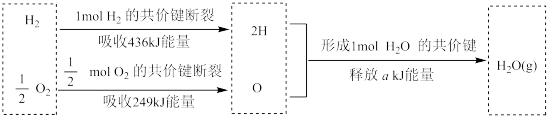
(3)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。根据如图信息,H与H2比较,较稳定的是____ ,计算a=_____ 。
(4)已知:Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
CO(g)+ O2(g)=CO2(g) △H2
O2(g)=CO2(g) △H2
C(石墨)+O2(g)=CO2(g) △H3
2Fe2O3(s)=4Fe(s)+3O2(g) △H4
请写出△H4与△H1、△H2、 △H3的关系___________ 。
(1)氢能是一种既高效又干净的新能源,发展前景良好,用氢能作能源的燃料电池汽车是研究的重点方向之一、下列说法正确的是___________(填字母)。
| A.氢燃料电池中H2在正极反应,O2在负极反应 |
| B.理论上氢能源汽车使用时不会产生污染物 |
| C.氢燃料电池可以将化学能完全转化为电能 |
| D.水分解产生氢气的同时放出热量供汽车使用 |

该过程实现了太阳能向
(3)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。根据如图信息,H与H2比较,较稳定的是

(4)已知:Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
CO(g)+
 O2(g)=CO2(g) △H2
O2(g)=CO2(g) △H2C(石墨)+O2(g)=CO2(g) △H3
2Fe2O3(s)=4Fe(s)+3O2(g) △H4
请写出△H4与△H1、△H2、 △H3的关系
您最近一年使用:0次



