FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:

①H2还原无水FeCl3制取FeCl2的化学方程式为________ 。
②B中盛放的试剂是____ ,按气流由左到右的方向,上述仪器的连接顺序为 ____ (填字母,装置可多次使用)。
③该制备装置的缺点为______ 。
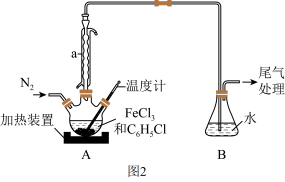
(2)利用反应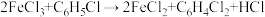 ,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
①仪器a的作用是_______ 。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____ (填名称),回收滤液中C6H5Cl的操作方法是____ 。
③在反应开始之前先通一段时间N2的目的是____ ,在反应完成后继续通一段时间N2的作用是____
④反应后将锥形瓶中溶液配成250 mL,量取25. 00 mL所配溶液,用0.40 mol·L-1 NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19. 70 mL,则氯化铁的转化率为____ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 易升华 | |
| 沸点/℃ | 132 | 173 | —— | —— |

①H2还原无水FeCl3制取FeCl2的化学方程式为
②B中盛放的试剂是
③该制备装置的缺点为
(2)利用反应
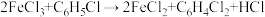 ,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
①仪器a的作用是
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是
③在反应开始之前先通一段时间N2的目的是
④反应后将锥形瓶中溶液配成250 mL,量取25. 00 mL所配溶液,用0.40 mol·L-1 NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19. 70 mL,则氯化铁的转化率为
更新时间:2019-12-26 15:38:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
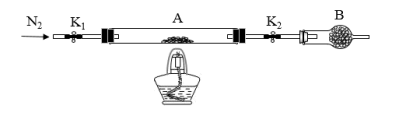
(1)将下列实验操作步骤正确排序___________ (填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.称量A的质量
b.点燃酒精灯,加热
c.熄灭酒精灯
d.关闭K1和K2
e.打开K1和K2,缓缓通入N2
f.冷却到室温
(2)根据实验记录,计算绿矾化学式中结晶水数目x=___________ (列式表示)。
(3)实验过程中如果出现下列操作,可能导致测定结果偏大的有___________ 。
A.实验时按a、d次序操作
B.实验过程中没有恒重操作
C.加热时间过长,导致SO2气体生成

(1)将下列实验操作步骤正确排序
a.称量A的质量
b.点燃酒精灯,加热
c.熄灭酒精灯
d.关闭K1和K2
e.打开K1和K2,缓缓通入N2
f.冷却到室温
(2)根据实验记录,计算绿矾化学式中结晶水数目x=
(3)实验过程中如果出现下列操作,可能导致测定结果偏大的有
A.实验时按a、d次序操作
B.实验过程中没有恒重操作
C.加热时间过长,导致SO2气体生成
您最近一年使用:0次
【推荐2】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:

回答下列问题:
(1)写出基态铁原子价层电子轨道表示式___________ 。
(2)步骤①混合研磨成细粉的主要目的是___________ 。
(3)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,化学方程式为___________ 。
(4)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入氧化剂___________ (填化学式),步骤⑤所得滤渣为___________ (填化学式)。
(5)步骤⑤所得滤液经过___________ (填操作)可得纯净干燥的MnSO4·H2O。
(6)步骤⑦中(NH4)2Sx+1分解需在90~100℃下进行,该反应除得到产品外,还产生一种酸性和一种碱性气体,写出其化学方程式___________ 。

回答下列问题:
(1)写出基态铁原子价层电子轨道表示式
(2)步骤①混合研磨成细粉的主要目的是
(3)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,化学方程式为
(4)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入氧化剂
(5)步骤⑤所得滤液经过
(6)步骤⑦中(NH4)2Sx+1分解需在90~100℃下进行,该反应除得到产品外,还产生一种酸性和一种碱性气体,写出其化学方程式
您最近一年使用:0次
【推荐3】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
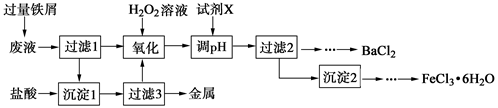
(1)沉淀1中含有的金属单质是_________ 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为__________________________ 。
(3)下列物质中,可以作为试剂X的是_____ (填字母)。
(4)制备氯化铁晶体过程中需保持盐酸过量,其目的是______________________ 。
(5)由过滤2得到的滤液制备BaCl2的实验操作依次为__________ 、冷却结晶、__________ 、洗涤、干燥。

(1)沉淀1中含有的金属单质是
(2)氧化时加入H2O2溶液发生反应的离子方程式为
(3)下列物质中,可以作为试剂X的是
| A.BaCl2 | B.BaCO3 | C.NaOH | D.Ba(OH)2 |
(4)制备氯化铁晶体过程中需保持盐酸过量,其目的是
(5)由过滤2得到的滤液制备BaCl2的实验操作依次为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】乙二胺四乙酸(EDTA,结构简式为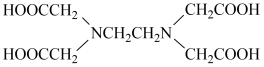 ,白色粉末,微溶于冷水,溶于乙醇、丙酮及部分有机溶剂)是一种重要的络合剂,用途很广。实验室常用氯乙酸(
,白色粉末,微溶于冷水,溶于乙醇、丙酮及部分有机溶剂)是一种重要的络合剂,用途很广。实验室常用氯乙酸( )、乙二胺(
)、乙二胺( )、NaOH为原料制备,工艺流程如下:
)、NaOH为原料制备,工艺流程如下:

回答下列问题:
(1)写出制备氯乙酸钠反应的化学方程式:___________ 。
(2)制备乙二胺四乙酸四钠所使用装置(加热及夹持仪器省略)如图所示。
①适宜的加热方式为___________ 。
②仪器Q的名称为___________ ;滴液漏斗中具支管的作用为___________ 。

③已知
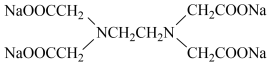
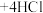 ,试分析该步骤使用NaOH的作用:
,试分析该步骤使用NaOH的作用:___________ 。
④“酸化”时,需调节混合液的 ,可用精密pH试纸或
,可用精密pH试纸或___________ (填仪器名称)测量混合液的pH。
⑤“系列操作”包括蒸发、冷却、过滤、洗涤、干燥。其中过滤时需要的玻璃仪器有烧杯、_______ 。
(3)根据流程中的数据,计算乙二胺四乙酸的产率为___________ %。
(4)利用新制的EDTA测定水的总硬度
用20mL移液管移取水样于250mL锥形瓶中,加氨性缓冲溶液6mL,1:1三乙醇胺溶液3mL(掩盖其他离子),EBT指示剂3~4滴,用 的EDTA标准溶液滴定,至终点时消耗10mLEDTA标准溶液[已知滴定时,
的EDTA标准溶液滴定,至终点时消耗10mLEDTA标准溶液[已知滴定时,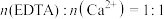 ]。该水样的硬度为
]。该水样的硬度为___________ 度(将水中的 和
和 都看作
都看作 ,并将其质量折算成CaO的质量,并把1L水中含10mgCaO称为1度)。
,并将其质量折算成CaO的质量,并把1L水中含10mgCaO称为1度)。
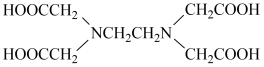 ,白色粉末,微溶于冷水,溶于乙醇、丙酮及部分有机溶剂)是一种重要的络合剂,用途很广。实验室常用氯乙酸(
,白色粉末,微溶于冷水,溶于乙醇、丙酮及部分有机溶剂)是一种重要的络合剂,用途很广。实验室常用氯乙酸( )、乙二胺(
)、乙二胺( )、NaOH为原料制备,工艺流程如下:
)、NaOH为原料制备,工艺流程如下:
回答下列问题:
(1)写出制备氯乙酸钠反应的化学方程式:
(2)制备乙二胺四乙酸四钠所使用装置(加热及夹持仪器省略)如图所示。
①适宜的加热方式为
②仪器Q的名称为

③已知

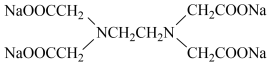
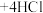 ,试分析该步骤使用NaOH的作用:
,试分析该步骤使用NaOH的作用:④“酸化”时,需调节混合液的
 ,可用精密pH试纸或
,可用精密pH试纸或⑤“系列操作”包括蒸发、冷却、过滤、洗涤、干燥。其中过滤时需要的玻璃仪器有烧杯、
(3)根据流程中的数据,计算乙二胺四乙酸的产率为
(4)利用新制的EDTA测定水的总硬度
用20mL移液管移取水样于250mL锥形瓶中,加氨性缓冲溶液6mL,1:1三乙醇胺溶液3mL(掩盖其他离子),EBT指示剂3~4滴,用
 的EDTA标准溶液滴定,至终点时消耗10mLEDTA标准溶液[已知滴定时,
的EDTA标准溶液滴定,至终点时消耗10mLEDTA标准溶液[已知滴定时,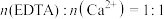 ]。该水样的硬度为
]。该水样的硬度为 和
和 都看作
都看作 ,并将其质量折算成CaO的质量,并把1L水中含10mgCaO称为1度)。
,并将其质量折算成CaO的质量,并把1L水中含10mgCaO称为1度)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】下图表示实验室中常见的玻璃仪器,请回答下列有关问题。

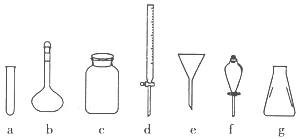
(1)用仪器的字母填空:能用酒精灯直接加热的仪器是________ ,使用前要检查是否漏水的仪器有________ ,要分离汽油和水的混合物,应选择的仪器是________ 。
(2)写出上述图中仪器的名称:b________ ; ①________ ;②________ 。
(3)c常用于盛放固体试剂,实验室中下列试剂不能盛放其中的是________ 。
A.烧碱 B.锌粒 C.活性炭 D.石灰石
(4)若利用装置h分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有_______ ,实验时仪器②中冷却水的进口为________ (选填“f”或“g”)。


(1)用仪器的字母填空:能用酒精灯直接加热的仪器是
(2)写出上述图中仪器的名称:b
(3)c常用于盛放固体试剂,实验室中下列试剂不能盛放其中的是
A.烧碱 B.锌粒 C.活性炭 D.石灰石
(4)若利用装置h分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】已知琥珀酸亚铁是常见治疗缺铁性贫血的补铁药剂的主要成分,该药品不溶于水但能溶于人体中的胃酸。请回答相关问题。
(1)常见治疗缺铁性贫血的补铁药剂通常都制成糖衣片,除了服用方便外它的另一个最重要的原因是___________________________ 。
(2)某同学为了检测某补铁药剂药片中Fe2+的存在,设计并进行了如下实验:
a.将药片去除糖衣,碾碎。
b.将碾碎的药片粉末转移到锥形瓶中,加入试剂A,过滤,得浅绿色溶液
c.向滤液中加入硫氰化钾溶液,溶液呈淡红色,加入几滴新制氯水,溶液立即出现血红色
d.向血红色溶液中继续滴加氯水,并振荡,静止几分钟,红色褪去。请回答下列问题
①操作a中碾碎药片所使用的主要仪器是__________ 。
②试剂A是___________ 。
③加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是_____________________________________ 。
④用方程式表示溶液出现血红色的原因__________________________ 。
⑤对溶液最后褪色的原因,甲、乙两位同学首先进行了猜想:
甲同学认为:可能是溶液中的+3价Fe又被还原为+2价Fe
乙同学认为:可能是溶液中的SCN-被过量的氯水氧化
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。_______________________________ 。
(1)常见治疗缺铁性贫血的补铁药剂通常都制成糖衣片,除了服用方便外它的另一个最重要的原因是
(2)某同学为了检测某补铁药剂药片中Fe2+的存在,设计并进行了如下实验:
a.将药片去除糖衣,碾碎。
b.将碾碎的药片粉末转移到锥形瓶中,加入试剂A,过滤,得浅绿色溶液
c.向滤液中加入硫氰化钾溶液,溶液呈淡红色,加入几滴新制氯水,溶液立即出现血红色
d.向血红色溶液中继续滴加氯水,并振荡,静止几分钟,红色褪去。请回答下列问题
①操作a中碾碎药片所使用的主要仪器是
②试剂A是
③加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
④用方程式表示溶液出现血红色的原因
⑤对溶液最后褪色的原因,甲、乙两位同学首先进行了猜想:
甲同学认为:可能是溶液中的+3价Fe又被还原为+2价Fe
乙同学认为:可能是溶液中的SCN-被过量的氯水氧化
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:

(1)实验室焙烧海带,需要下列仪器中的________________ (填序号)。
a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
(2)指出提取碘的过程中有关的实验操作③的名称是________________ ,所用主要仪器是________________ 。
(3)提取碘的过程中,可选择的有机试剂是________________
A.甲苯、酒精 B.四氯化碳、苯C.汽油、乙酸 D.汽油、甘油
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的错误之处:
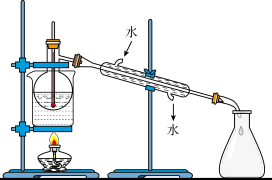
①________________ ;
②________________ ;
③________________ 。
(5)进行上述蒸馏操作时,使用水浴加热的原因是________________ ,最后晶态碘在________________ (填仪器名称)里聚集。

(1)实验室焙烧海带,需要下列仪器中的
a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
(2)指出提取碘的过程中有关的实验操作③的名称是
(3)提取碘的过程中,可选择的有机试剂是
A.甲苯、酒精 B.四氯化碳、苯C.汽油、乙酸 D.汽油、甘油
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的错误之处:

①
②
③
(5)进行上述蒸馏操作时,使用水浴加热的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室制取溴苯的装置如图所示。
有关数据如下:
回答下列问题:
(1)仪器a的作用是___________ 。
(2)二颈烧瓶中生成有机物发生反应的化学方程式为___________ 。
(3)A装置盛装___________ (填试剂)用于检验诱导期已过,反应开始。当出现 ___________ (填现象)时,证明反应已结束。
(4)取反应后的混合物,经过一系列操作得到纯净的溴苯:
①水洗除去___________ ,分液;
②用NaOH稀溶液洗涤,除去___________ ,分液;
③水洗,分液;
④用干燥剂干燥,过滤;
⑤___________ ,分离溴苯和苯。
(5)经过一系列操作得到纯净的溴苯5ml,产率为___________ (保留三位有效数字)。
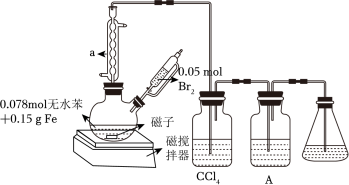
有关数据如下:
| 物质 | 苯 | 溴 | 溴苯 |
| 密度(g•cm﹣3) | 0.88 | 3.12 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解性 | 不溶 | 微溶 | 不溶 |
(1)仪器a的作用是
(2)二颈烧瓶中生成有机物发生反应的化学方程式为
(3)A装置盛装
(4)取反应后的混合物,经过一系列操作得到纯净的溴苯:
①水洗除去
②用NaOH稀溶液洗涤,除去
③水洗,分液;
④用干燥剂干燥,过滤;
⑤
(5)经过一系列操作得到纯净的溴苯5ml,产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】合成正丁醛的实验装置如图所示。
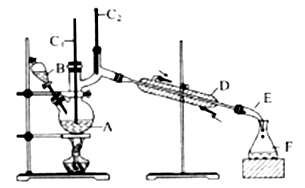
发生的反应如下:CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃在F中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由________ 。
(2)加入沸石的作用是________ 。若加热后发现未加沸石,应采取的正确方法是________ 。
(3)上述装置图中,E仪器的名称是________ ,D仪器的名称是________ 。
(4)分液漏斗使用前必须进行的操作是________ (填正确答案标号)。
a.润湿b.干燥c.检漏d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________ 层(填“上”或“下”)。

发生的反应如下:CH3CH2CH2CH2OH
 CH3CH2CH2CHO
CH3CH2CH2CHO(正丁醇)(正丁醛)
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃在F中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由
(2)加入沸石的作用是
(3)上述装置图中,E仪器的名称是
(4)分液漏斗使用前必须进行的操作是
a.润湿b.干燥c.检漏d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应;熔点为-80℃,沸点137.l℃。在熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2:b→___ ;
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___ 。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2:b→
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如图装置由二氧化氯制备NaClO2·3H2O,并探究其性质。

I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
(1)盛放NaClO3和Na2SO3固体的仪器名称是___ 。
(2)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶;②___ ;③用38℃~60℃热水洗涤;④在38℃~60℃间进行干燥,得到成品。
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为___ 。
(4)装置D是处理尾气,反应的化学方程式___ 。
Ⅲ.测量与计算:
(5)利用题中原理制备出NaClO2·3H2O(M=144.5g/mol)晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,(已知:ClO +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。①滴定终点的现象是
+2I-)。①滴定终点的现象是___ 。②样品中NaClO2·3H2O的纯度为___ %(用含c、v的代数式表示)。

I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
(1)盛放NaClO3和Na2SO3固体的仪器名称是
(2)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶;②
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为
(4)装置D是处理尾气,反应的化学方程式
Ⅲ.测量与计算:
(5)利用题中原理制备出NaClO2·3H2O(M=144.5g/mol)晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。①滴定终点的现象是
+2I-)。①滴定终点的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】连二硫酸钠( )广泛应用于工业和日常生活中.实验室可利用如下转化及装置制取
)广泛应用于工业和日常生活中.实验室可利用如下转化及装置制取 :
: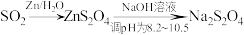 .已知:
.已知: 与
与 性质相似,具有两性;
性质相似,具有两性;________ ,连接好装置后的第一步操作是________________ ;
(2)实验开始时应先打开仪器________ (填“a”或“b”)的活塞;
(3)在装置A和B之间安装单向阀的目的是________ ;
(4)转化中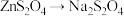 的化学方程式为
的化学方程式为________ ;
(5)反应中 溶液不能过量加入的原因是
溶液不能过量加入的原因是________ ;
(6)反应结束后,将三颈烧瓶中的混合液过滤,滤液经“一系列操作”得到 产品.称取
产品.称取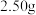 产品,溶于冷水并配成
产品,溶于冷水并配成 溶液,取出
溶液,取出 于锥形瓶中,加入亚甲基蓝作指示剂,用
于锥形瓶中,加入亚甲基蓝作指示剂,用 碱性
碱性 标准液滴定,平行滴定三次,平均消耗标准液的体积为
标准液滴定,平行滴定三次,平均消耗标准液的体积为 .(杂质不参加反应)
.(杂质不参加反应)
①已知滴定过程中 与
与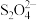 反应生成
反应生成 和
和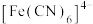 ,反应的离子方程式为
,反应的离子方程式为________ ;
②该样品中 质量分数为
质量分数为________ %;
 )广泛应用于工业和日常生活中.实验室可利用如下转化及装置制取
)广泛应用于工业和日常生活中.实验室可利用如下转化及装置制取 :
: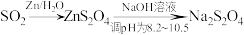 .已知:
.已知: 与
与 性质相似,具有两性;
性质相似,具有两性;
(2)实验开始时应先打开仪器
(3)在装置A和B之间安装单向阀的目的是
(4)转化中
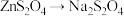 的化学方程式为
的化学方程式为(5)反应中
 溶液不能过量加入的原因是
溶液不能过量加入的原因是(6)反应结束后,将三颈烧瓶中的混合液过滤,滤液经“一系列操作”得到
 产品.称取
产品.称取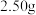 产品,溶于冷水并配成
产品,溶于冷水并配成 溶液,取出
溶液,取出 于锥形瓶中,加入亚甲基蓝作指示剂,用
于锥形瓶中,加入亚甲基蓝作指示剂,用 碱性
碱性 标准液滴定,平行滴定三次,平均消耗标准液的体积为
标准液滴定,平行滴定三次,平均消耗标准液的体积为 .(杂质不参加反应)
.(杂质不参加反应)①已知滴定过程中
 与
与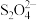 反应生成
反应生成 和
和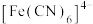 ,反应的离子方程式为
,反应的离子方程式为②该样品中
 质量分数为
质量分数为
您最近一年使用:0次



