按要求作答
(1)钴位于元素周期表的第__ 族,其基态原子中未成对电子个数为__ 。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__ ,所含非金属元素的电负性由大到小的顺序是__ 。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__ 。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__ Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__ 。
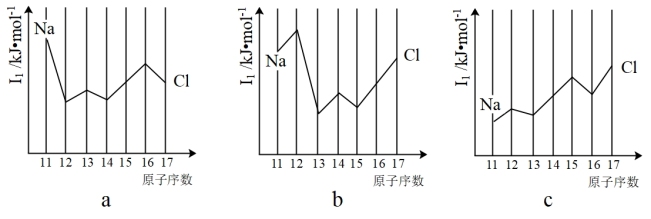
A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
19-20高二上·宁夏石嘴山·期末 查看更多[4]
更新时间:2020-01-10 16:24:42
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】已知元素M是组成物质NH4Al(SO4)2的其中一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)元素M是__________________ (填元素符号)。
(2)基态氮原子核外有_____________ 种不同运动状态的电子,有_____ 种能量不同的电子。
(3)NH4Al(SO4)2中,电负性最大的元素是________ (填元素符号),S的_______ 杂化轨道与O的2p轨道形成_________ 键。
(4)金属铝中,Al原子采取面心立方最密堆积,其晶胞参数为anm。晶胞中铝原子的配位数为____________ ,Al原子的半径是________ nm。
| I1 | I2 | I3 | I4 | |
| 电离能(kJ·mol-1) | 578 | 1817 | 2745 | 11578 |
(1)元素M是
(2)基态氮原子核外有
(3)NH4Al(SO4)2中,电负性最大的元素是
(4)金属铝中,Al原子采取面心立方最密堆积,其晶胞参数为anm。晶胞中铝原子的配位数为
您最近一年使用:0次
【推荐2】(1)①Cu元素基态原子的外围电子排布式为______________ 。
②元素C、N、O的第一电离能由大到小的排列顺序为________ 。
(2)下列说法正确的是________ (填序号)。
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
(3)①锗(Ge)是用途很广的半导体材料,基态锗原子的外围电子排布式为________ 。
②在第二周期中,第一电离能位于硼元素与氮元素之间的元素有________ 种。
(4)硼(B)及其化合物在化学中有重要的地位。请回答下列问题:Ga与B同主族,Ga的基态原子的核外电子排布式为________ ,B、C、O三种元素的第一电离能由大到小的顺序是________ 。
②元素C、N、O的第一电离能由大到小的排列顺序为
(2)下列说法正确的是
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
(3)①锗(Ge)是用途很广的半导体材料,基态锗原子的外围电子排布式为
②在第二周期中,第一电离能位于硼元素与氮元素之间的元素有
(4)硼(B)及其化合物在化学中有重要的地位。请回答下列问题:Ga与B同主族,Ga的基态原子的核外电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】A、B、C、D、E五种前四周期的元素,原子序数依次增大,其相关信息如下:
请回答下列问题:
(1)E位于元素周期表第________ 周期第_________ 族,其简化电子排布式为_________ ;
(2)D原子最外层电子排布图是_________________ ;
(3)A和B按照 1:1组成的相对分子质量最小的化合物甲中
①每个甲分子中含有__________ 个σ键;
②甲气体常用作燃料电池的负极材料,写出在NaOH溶液中甲用作负极的电极反应式____________ ;
(4)A和C组成的固体化合物AC5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,写出固体化合物AC5的电子式_________________ ;
(5)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物的性质相似,如Li和Mg,试写出向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:______________ 。
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 核外有3种不同原子轨道,每个轨道容纳的电子数相等 |
| C | 基态时,2p轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 是目前生产、生活中应用最广泛的金属 |
请回答下列问题:
(1)E位于元素周期表第
(2)D原子最外层电子排布图是
(3)A和B按照 1:1组成的相对分子质量最小的化合物甲中
①每个甲分子中含有
②甲气体常用作燃料电池的负极材料,写出在NaOH溶液中甲用作负极的电极反应式
(4)A和C组成的固体化合物AC5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,写出固体化合物AC5的电子式
(5)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物的性质相似,如Li和Mg,试写出向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)下列物质中:① ②金刚石 ③NaCl ④
②金刚石 ③NaCl ④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨Ne。只含离子键的是
⑨Ne。只含离子键的是_______ (填序号,下同 ),既含离子键又含共价键的是_______ ,不存在化学键的是_______ ,属于离子晶体的是_______ ,属于共价晶体的是_______ ,属于分子晶体的是_______ 。
(2)二氯化二硫 是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
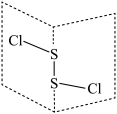
① 的化学键类型为
的化学键类型为_______ (填“极性键”、“非极性键”或“极性键和非极性键”),它是_______ (填“极性”或“非极性”)分子。
②电负性:S_______ (填“>”或“<”)Cl, 中硫元素的化合价为
中硫元素的化合价为_______ 。
③ 分子中每个S原子有
分子中每个S原子有_______ 个孤电子对。
(1)下列物质中:①
 ②金刚石 ③NaCl ④
②金刚石 ③NaCl ④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨Ne。只含离子键的是
⑨Ne。只含离子键的是(2)二氯化二硫
 是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
①
 的化学键类型为
的化学键类型为②电负性:S
 中硫元素的化合价为
中硫元素的化合价为③
 分子中每个S原子有
分子中每个S原子有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】C、Si、S和N元素在化学中占有极其重要的地位。
(1)写出Si的基态原子价电子排布式______ 。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______ 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______ ,微粒间存在的作用力是______ 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是______ 。
(4)SO2、NO2、H2S同属于______ 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是______ 。
(1)写出Si的基态原子价电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是
(4)SO2、NO2、H2S同属于
您最近一年使用:0次
【推荐3】回答下列问题:
(1)书写下列元素基态原子或离子的电子排布式C_______ 、O_______ 、Na_______ 、Cl_______ 、Ca_______ 、Al3+_______ 、Fe_______ 、Co_______ 、Ni_______ 。
(2)H、C、N的电负性由大到小的顺序为_______ 。
(3)F、O、N、Ni的第一电离能由大到小的顺序为_______ 。
(4)C、H、O三种元素的电负性由小到大的顺序为_______ 。
(5)C、O、Si三种元素电负性由大到小的顺序为_______ ;第一电离能:Si_______ Ge, P_______ S(填>或<)。
(1)书写下列元素基态原子或离子的电子排布式C
(2)H、C、N的电负性由大到小的顺序为
(3)F、O、N、Ni的第一电离能由大到小的顺序为
(4)C、H、O三种元素的电负性由小到大的顺序为
(5)C、O、Si三种元素电负性由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】完成下列问题。
(1)同分异构是_______ 相同而_______ 不同的有机化合物互为同分异构体。
(2)有机化合物CH3-CH2-CH=CH2中含有_______ 个σ键,_______ 个ᅲ键。
(3)用电解法精炼粗铜时,粗铜作_______ 极,纯铜作_______ 极。
(4)电镀时,通常把待镀的金属作_______ 极,镀层金属作_______ 极。
(1)同分异构是
(2)有机化合物CH3-CH2-CH=CH2中含有
(3)用电解法精炼粗铜时,粗铜作
(4)电镀时,通常把待镀的金属作
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题:
(1)肼(N2H4)分子可视为NH3中的一个氢原子被—NH2(氨基)取代形成的氢化物。
①NH3分子的VSEPR模型是___________ ;N2H4分子中氮原子轨道的杂化类型是___________ 。
②肼作火箭燃料:N2O4+2N2H4=3N2+4H2O若反应中有4 mol N—H键断裂,则形成的π键有___________ mol。
(2)VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。H2Se的热稳定性比H2S___________ (填“强”或“弱”)。SO 离子的立体构型为
离子的立体构型为___________ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___________ 。CO与N2结构相似,CO分子内σ键与π键个数之比为___________ 。
(1)肼(N2H4)分子可视为NH3中的一个氢原子被—NH2(氨基)取代形成的氢化物。
①NH3分子的VSEPR模型是
②肼作火箭燃料:N2O4+2N2H4=3N2+4H2O若反应中有4 mol N—H键断裂,则形成的π键有
(2)VIA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。H2Se的热稳定性比H2S
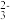 离子的立体构型为
离子的立体构型为(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】按要求回答下列问题
(1) 中心原子采用
中心原子采用____ 杂化,其键角比 中键角
中键角______ (填“大”或“小”),原因是:________________________ 。
(2)有如下分子:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦HCl⑧
⑦HCl⑧ ⑨
⑨ ⑩
⑩
①上述分子中每个原子周围都满足8电子结构的是______ (填序号)。
② 分子中σ键和π键个数之比为
分子中σ键和π键个数之比为____________ 。
③含有极性键的极性分子有______ (填序号)。
④空间结构为三角锥形的分子是______ (填序号)。
(3)某有机物结构如图所示,下列说法正确的是______ (填序号)。

①分子中σ键和π键之比为9∶3 ②该物质中既有极性键也有非极性键
③分子中C原子的杂化方式为 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
(1)
 中心原子采用
中心原子采用 中键角
中键角(2)有如下分子:①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦HCl⑧
⑦HCl⑧ ⑨
⑨ ⑩
⑩
①上述分子中每个原子周围都满足8电子结构的是
②
 分子中σ键和π键个数之比为
分子中σ键和π键个数之比为③含有极性键的极性分子有
④空间结构为三角锥形的分子是
(3)某有机物结构如图所示,下列说法正确的是

①分子中σ键和π键之比为9∶3 ②该物质中既有极性键也有非极性键
③分子中C原子的杂化方式为
 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
您最近一年使用:0次



