2016年中国科学家成功合成NiO/TiO2电解水催化剂和新型高效的钙钛矿太阳能电池,为解决能源危机保护环境作出了重大贡献。请回答下列问题:
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2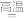 TiCl4+2CO。
TiCl4+2CO。
①基态钛原子的价电子排布式为_________________ 。
②该反应中涉及到的非金属元素的电负性大小顺序为_______________________ 。
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:
化合物甲的沸点小于化合物乙的沸点,主要原因是___________________ 。在化合物乙中,氧原子的杂化方式是______________ 。
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角______ (填“大”或“小”),原因是_____________ 。
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是____ 。
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
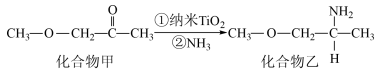
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。
①请回答,金属钛晶胞的结构属于____________ 。
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为______________ 。
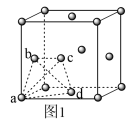
(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量________ g·mol-1。(用含d、ρ等符号的式子表示,用NA表示阿伏加 德罗常数的值)
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2
 TiCl4+2CO。
TiCl4+2CO。①基态钛原子的价电子排布式为
②该反应中涉及到的非金属元素的电负性大小顺序为
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:

化合物甲的沸点小于化合物乙的沸点,主要原因是
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。

①请回答,金属钛晶胞的结构属于
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为

(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量
更新时间:2020-03-20 11:11:37
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钕铁硼磁铁在绝对零度时磁性仅次于钬磁铁,但是在常温下磁性远远强于目前已知的所有永久磁铁。生产钕铁硼磁铁的主要原料有稀土金属钕、纯铁、铝硼及其他稀土原料。
(1)钕(Nd)为60号元素,在周期表中第_____ 周期。
(2)①铝原子激发态的电子排布式有_____ (填标号,下同) ,其中能量较高的是_____ 。
A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_____ 分子(填“极性”或“非极性”),分子中Al采取_____ 杂化。

(3)硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为________________ (用元素符号
表示)。晶体硼的熔点比晶体硅高,原因是_______________________________ 。
(4)羰基铁[ Fe(CO)5]与二茂铁[ Fe(C5H5)2]是两种重要的配合物。测定表明二茂铁中配体环戊二烯离子的结构简式为 ,且所有氢原子的化学环境都相同,则下列说法中正确的是
,且所有氢原子的化学环境都相同,则下列说法中正确的是_____ (填标号)。
A.二茂铁的中心粒子与配体间存在离子键,且配体中存在一个 键
键
B.羰基铁中,配位原子为C原子,且配体与CN- 是等电子体
C.两种配合物的中心粒子价电子排布图均为

D.1 mol羰基铁中有10 NA个σ键和10NA个π键
(5)已知氮化硼( BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构; 立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。

①六方相氮化硼结构与石墨相似,但是却不导电的原因是____________________________________ 。
②立方相氮化硼中,离硼原子最近且等距离的硼原子有____ 个。
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm=____ m3·mol-1 (列出计算式)。
(1)钕(Nd)为60号元素,在周期表中第
(2)①铝原子激发态的电子排布式有
A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于

(3)硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为
表示)。晶体硼的熔点比晶体硅高,原因是
(4)羰基铁[ Fe(CO)5]与二茂铁[ Fe(C5H5)2]是两种重要的配合物。测定表明二茂铁中配体环戊二烯离子的结构简式为
 ,且所有氢原子的化学环境都相同,则下列说法中正确的是
,且所有氢原子的化学环境都相同,则下列说法中正确的是A.二茂铁的中心粒子与配体间存在离子键,且配体中存在一个
 键
键B.羰基铁中,配位原子为C原子,且配体与CN- 是等电子体
C.两种配合物的中心粒子价电子排布图均为


D.1 mol羰基铁中有10 NA个σ键和10NA个π键
(5)已知氮化硼( BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构; 立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。

①六方相氮化硼结构与石墨相似,但是却不导电的原因是
②立方相氮化硼中,离硼原子最近且等距离的硼原子有
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________ (从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为_____________ ,其中C原子的杂化形式是_________ 。
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________ (填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________ (从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。

(3)FeCl3晶体熔点为306℃,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:____________________________________________ 。
(4)“愚人金”是铁硫化合物,其晶体的晶胞如图所示。该晶体的化学式______________ 。

(1)K4[Fe(CN)6]配合物中存在的作用力类型有
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是

(3)FeCl3晶体熔点为306℃,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:
(4)“愚人金”是铁硫化合物,其晶体的晶胞如图所示。该晶体的化学式

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】X、Y、Z、M、W均为周期表中前四周期的元素.X元素的基态原子外围电子排布式为3s2;Y原子的L能层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;W为过渡元素,它的基态原子外围电子排布成对的电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为____________ 其基态原子核外有____________ 种不同电子运动状态;
(2)Z的氢化物的沸点比其下一周期同族元素氢化物的沸点高的原因是____________ 。
(3)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为____________ ;与YM分子互为等电子体的离子的化学式为____________ 。(写一种即可)
(4)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为____________ ,A、B中W原子的配位数之比为____________ 。A、B晶胞的棱长分别为acm和bcm,则A、B两种晶体的密度之比为____________ 。
(5)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X)。则该合金的化学式为________________________ 。

(1)W的基态原子的外围电子排布图为
(2)Z的氢化物的沸点比其下一周期同族元素氢化物的沸点高的原因是
(3)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为
(4)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为
(5)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X)。则该合金的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】半导体芯片的关键材料是我国优先发展的新材料。经过半个多世纪的发展,硅基材料的半导体器件性能已经接近其物理极限,以碳化硅、氮化镓等为代表的第二代半导体材料成为当今热点。回答下列问题:
(1)基态镓原子的价电子排布式为:___________ , 它位于元素周期表的第___________ 周期、第___________ 族。
(2)上述材料所涉及的四种元素中,原子半径最小的是___________ (填元素符号,下同),第一电离能I1最大的是___________ 。
(3)原硅酸根SiO 的空间构型是
的空间构型是___________ ,其中Si的杂化轨道类型为___________ 。
(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是___________ (填序号),原因是___________ 。
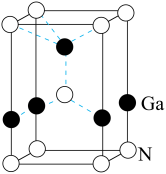
(5)GaN 被誉为21世纪引领5G 时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数为:α=β=90°,γ=120°。已知:该晶体的密度为ρg/cm3,晶胞底边边长为a cm,高为b cm,则阿伏加德罗常数为___________ mol—1(用含a、b、ρ的代数式表示)。
(1)基态镓原子的价电子排布式为:
(2)上述材料所涉及的四种元素中,原子半径最小的是
(3)原硅酸根SiO
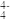 的空间构型是
的空间构型是(4)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是
(5)GaN 被誉为21世纪引领5G 时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数为:α=β=90°,γ=120°。已知:该晶体的密度为ρg/cm3,晶胞底边边长为a cm,高为b cm,则阿伏加德罗常数为


您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】回答问题
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了 等多种元素。上述元素中基态原子未成对电子数与
等多种元素。上述元素中基态原子未成对电子数与 相同的有
相同的有___________ 。
(2)元素铋主要用于制造易熔金属合金,元素Bi位于第6周期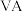 族,其基态原子的价电子排布式为
族,其基态原子的价电子排布式为___________ 。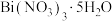 中各元素电负性从大到小的顺序为
中各元素电负性从大到小的顺序为___________ 。
(3) 均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
①下列状态的 原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________ (填序号,下同),未成对电子最多的是___________ 。
a.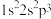 b.
b. c.
c.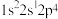 d.
d.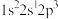
②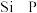 与S是同周期中相邻的元素,第一电离能由大到小的顺序是
与S是同周期中相邻的元素,第一电离能由大到小的顺序是___________ 。
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了
 等多种元素。上述元素中基态原子未成对电子数与
等多种元素。上述元素中基态原子未成对电子数与 相同的有
相同的有(2)元素铋主要用于制造易熔金属合金,元素Bi位于第6周期
 族,其基态原子的价电子排布式为
族,其基态原子的价电子排布式为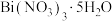 中各元素电负性从大到小的顺序为
中各元素电负性从大到小的顺序为(3)
 均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:①下列状态的
 原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是a.
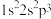 b.
b. c.
c.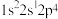 d.
d.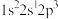
②
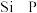 与S是同周期中相邻的元素,第一电离能由大到小的顺序是
与S是同周期中相邻的元素,第一电离能由大到小的顺序是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为___ 。
(2)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有____ 。
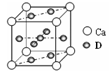
(4)基态D原子的核外电子排布式为____ ,右图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为___ 。
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:___ 。

(1)A、B、C的第一电离能由小到大的顺序为
(2)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有
(4)基态D原子的核外电子排布式为
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】I.Fe、Ni均为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)基态Fe原子的原子结构示意图为_______ ,依倨电子排布特点,铁属于元素周期表中_______ 区元素。
(2)甘氨酸亚铁络合物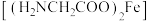 是一种新型的铁营养强化剂。
是一种新型的铁营养强化剂。
① 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为_______ 。
②甘氨酸 的沸点比相同相对分子质量的烷烃高很多,原因是
的沸点比相同相对分子质量的烷烃高很多,原因是_______ 。
II.砷化镓( )是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
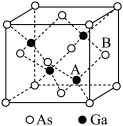
(3)基态Ga原子的核外电子排布式为[Ar]_______ 。
(4)根据元素周期律,元素的电负性Ga_______ (填“大于”或“小于”,下同)As。
(5)杀虫剂 中As原子采取
中As原子采取_______ 杂化。
(6)共价晶体 的晶胞参数
的晶胞参数 ,它的晶胞结构如图所示,该晶体的密度为
,它的晶胞结构如图所示,该晶体的密度为_______ (阿伏加德罗常数的值用NA表示) 。
。
(1)基态Fe原子的原子结构示意图为
(2)甘氨酸亚铁络合物
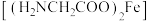 是一种新型的铁营养强化剂。
是一种新型的铁营养强化剂。①
 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为②甘氨酸
 的沸点比相同相对分子质量的烷烃高很多,原因是
的沸点比相同相对分子质量的烷烃高很多,原因是II.砷化镓(
 )是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:(3)基态Ga原子的核外电子排布式为[Ar]
(4)根据元素周期律,元素的电负性Ga
(5)杀虫剂
 中As原子采取
中As原子采取(6)共价晶体
 的晶胞参数
的晶胞参数 ,它的晶胞结构如图所示,该晶体的密度为
,它的晶胞结构如图所示,该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】高温乃至室温超导一直是科学家不懈追求目标。科学家合成了一种高温超导材料,其晶胞结构如图所示(B和C原子均位于晶胞面上),该立方晶胞参数为apm。
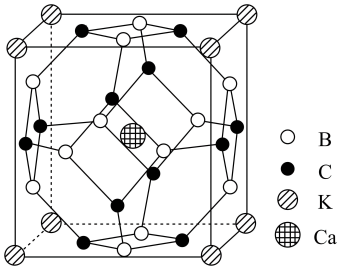
(1)该晶体的四种元素的电负性由大到小的顺序是___________ 。钙元素的焰色实验为砖红色,基于其原理可用于定性与定量分析,这种分析方法称为___________ 光谱。
(2)该晶体中,B原子的杂化轨道类型是_______ ,C原子的杂化轨道类型是________ 。
(3)该晶体中微粒间存在的化学键有_________ 、___________ 。
(4)该晶体的化学式为________ (化成最简整数比),密度为_________  (列出计算式,相对分子质量用M表示无需计算出数值)。
(列出计算式,相对分子质量用M表示无需计算出数值)。
(5)晶胞中B和C原子构成的多面体有_________ 个面
(6)比较 与
与 的沸点并解释原因
的沸点并解释原因_________ ;比较 与
与 的键角并解释原因
的键角并解释原因___________ 。

(1)该晶体的四种元素的电负性由大到小的顺序是
(2)该晶体中,B原子的杂化轨道类型是
(3)该晶体中微粒间存在的化学键有
(4)该晶体的化学式为
 (列出计算式,相对分子质量用M表示无需计算出数值)。
(列出计算式,相对分子质量用M表示无需计算出数值)。(5)晶胞中B和C原子构成的多面体有
(6)比较
 与
与 的沸点并解释原因
的沸点并解释原因 与
与 的键角并解释原因
的键角并解释原因
您最近一年使用:0次
【推荐3】A~G是周期表中1~36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的元素;D的基态原子2p能级上的未成对电子数与B原子相同;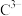 与
与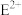 具有相同的稳定的电子层结构;F元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;G元素的基态原子在前四周期中未成对电子数最多。
具有相同的稳定的电子层结构;F元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;G元素的基态原子在前四周期中未成对电子数最多。
(1)A的元素符号为_______ ,基态G原子的电子排布式为_______ 。
(2)B、C、D三种元素第一电离能从大到小的顺序是_______ (填元素符号)。
(3)已知元素的电负性C>F,则C元素与F元素形成的化合物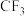 中C的化合价为
中C的化合价为_______ 价,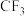 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为_______ 。
(4)E与C元素形成的化合物的化学式为_______ ,B和C形成的化合物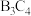 中B显
中B显_______ 价。
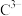 与
与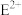 具有相同的稳定的电子层结构;F元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;G元素的基态原子在前四周期中未成对电子数最多。
具有相同的稳定的电子层结构;F元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;G元素的基态原子在前四周期中未成对电子数最多。(1)A的元素符号为
(2)B、C、D三种元素第一电离能从大到小的顺序是
(3)已知元素的电负性C>F,则C元素与F元素形成的化合物
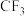 中C的化合价为
中C的化合价为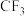 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为(4)E与C元素形成的化合物的化学式为
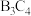 中B显
中B显
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】磷酸亚铁锂( )是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:
)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为___________ ;基态磷原子第一电离能比基态硫的___________ (填“大”或“小”),原因是___________ 。
(2)实验室中可用KSCN或 来检验
来检验 。
。 与KSCN溶液混合,可得到配位数为5的配合物的化学式是
与KSCN溶液混合,可得到配位数为5的配合物的化学式是___________ ,其中硫、碳的杂化类型分别是___________ 、___________ 。
(3)磷酸和亚磷酸( )是磷元素的两种含氧酸。
)是磷元素的两种含氧酸。 的空间构型为
的空间构型为___________ ;亚磷酸与NaOH反应只生成 和
和 两种盐,则
两种盐,则 的结构简式为
的结构简式为___________ 。
(4) 和
和 都是三角锥形分子,但键角
都是三角锥形分子,但键角 ,可能的原因是
,可能的原因是___________ 。
(5)氧化亚铁晶体的晶胞如图。已知:氧化亚铁晶体的密度为ρ g⋅cm ,
, 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与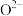 紧邻且等距离的
紧邻且等距离的 数目为
数目为___________ , 与
与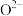 最短核间距为
最短核间距为___________ pm。
 )是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:
)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。回答下列问题:(1)基态锂原子核外能量最高的电子电子云轮廓图形状为
(2)实验室中可用KSCN或
 来检验
来检验 。
。 与KSCN溶液混合,可得到配位数为5的配合物的化学式是
与KSCN溶液混合,可得到配位数为5的配合物的化学式是(3)磷酸和亚磷酸(
 )是磷元素的两种含氧酸。
)是磷元素的两种含氧酸。 的空间构型为
的空间构型为 和
和 两种盐,则
两种盐,则 的结构简式为
的结构简式为(4)
 和
和 都是三角锥形分子,但键角
都是三角锥形分子,但键角 ,可能的原因是
,可能的原因是(5)氧化亚铁晶体的晶胞如图。已知:氧化亚铁晶体的密度为ρ g⋅cm
 ,
, 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与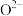 紧邻且等距离的
紧邻且等距离的 数目为
数目为 与
与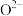 最短核间距为
最短核间距为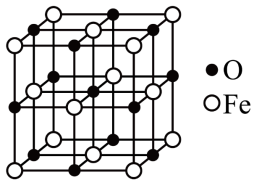
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】铜是人类知道最早的金属之一。回答下列问题:
(1)基态铜原子价层电子排布图为___________ ,其核外占据最高能层电子的电子云轮廓图的形状为___________ 。
(2) 晶胞结构如下图所示。
晶胞结构如下图所示。
①区别晶体与非晶体最科学的方法是___________ ;该晶胞中铜原子的配位数为___________ 。
②若位于O点的 原子的坐标为(0,0,0),A点的Cu原子的坐标为(0,
原子的坐标为(0,0,0),A点的Cu原子的坐标为(0, ,
, ),则晶胞中B处Cl原子的坐标为
),则晶胞中B处Cl原子的坐标为___________ 。

(3)某铜氧化合物是一种杀菌剂和陶瓷的着色剂,其立方晶胞如图所示。若 原子之间最短距离为
原子之间最短距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为___________  (列出计算式即可,已知Cu-64,O-16)。
(列出计算式即可,已知Cu-64,O-16)。

(1)基态铜原子价层电子排布图为
(2)
 晶胞结构如下图所示。
晶胞结构如下图所示。①区别晶体与非晶体最科学的方法是
②若位于O点的
 原子的坐标为(0,0,0),A点的Cu原子的坐标为(0,
原子的坐标为(0,0,0),A点的Cu原子的坐标为(0, ,
, ),则晶胞中B处Cl原子的坐标为
),则晶胞中B处Cl原子的坐标为
(3)某铜氧化合物是一种杀菌剂和陶瓷的着色剂,其立方晶胞如图所示。若
 原子之间最短距离为
原子之间最短距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为 (列出计算式即可,已知Cu-64,O-16)。
(列出计算式即可,已知Cu-64,O-16)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:
(1)基态S原子的价电子排布图为_______ 。
(2)硫氰酸根离子(SCN-)的结构式为_______ 。
(3)甲脒(FA)的结构简式为
①其组成元素的电负性由小到大的排序为_______ ,其中碳原子的杂化方式为_______ 。
②甲脒比丙烷的熔点更高的原因是_______ 。
(4)水中铅测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(图1)

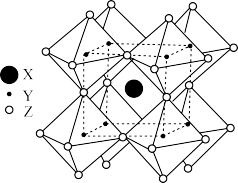
图1 图2
①该络合物可溶于四氯化碳,其晶体类型为_______ 。
②该络合物分子内不存在的微粒间作用力有_______ 。(选填序号)
a.σ键b.π键c.非极性键d.配位键e.离子键
(5)FAPbI3的晶体结构单元如图2所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为___ 。
(1)基态S原子的价电子排布图为
(2)硫氰酸根离子(SCN-)的结构式为
(3)甲脒(FA)的结构简式为

①其组成元素的电负性由小到大的排序为
②甲脒比丙烷的熔点更高的原因是
(4)水中铅测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(图1)


图1 图2
①该络合物可溶于四氯化碳,其晶体类型为
②该络合物分子内不存在的微粒间作用力有
a.σ键b.π键c.非极性键d.配位键e.离子键
(5)FAPbI3的晶体结构单元如图2所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为
您最近一年使用:0次



