氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:
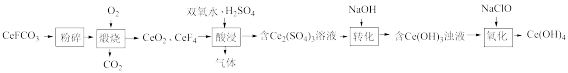
回答下列问题:
(1)“煅烧”可在_______ (填仪器名称)中进行,主要反应的化学方程式为________ ;除“粉碎”外,还可以加快“煅烧”速率的措施有_________ (只答一点即可)。
(2)实验室制取氧气。
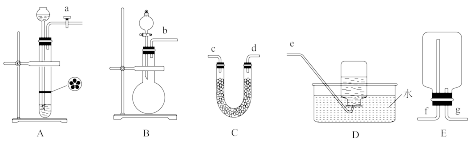
①氧气的发生装置可以选择上图中的__________ (填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→________ (填小写字母);检验氧气已收集满的操作和现象为________ 。
(3)“酸浸”时,温度不能过高的原因为_______ ;若用盐酸代替双氧水、H2SO4的不足之处为____________ ;该步骤不能使用陶瓷容器的原因为___________________ 。
(4)“氧化”反应的化学方程式为_________________________________ 。
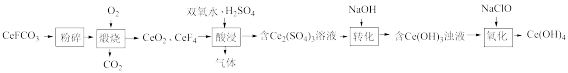
回答下列问题:
(1)“煅烧”可在
(2)实验室制取氧气。
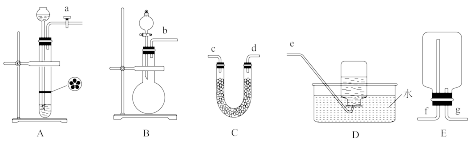
①氧气的发生装置可以选择上图中的
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→
(3)“酸浸”时,温度不能过高的原因为
(4)“氧化”反应的化学方程式为
2020·广东·模拟预测 查看更多[3]
四省(河南、广东、湖南、湖北四省)肇庆中学等部分学校2020届高三联考理综化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验
更新时间:2020-04-01 20:22:31
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】高铁酸钾(K2FeO4) 是一新型高效无毒的多功能水处理剂,可除水中氨氮、硫化物、藻类等。K2FeO4易溶于水,微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
I.制备K2FeO4
实验室利用如图装置制备K2FeO4,其原理如下:3Cl2+ 2Fe (OH)3+ 10KOH= 2K2FeO4+ 6KCl+ 8H2O。

(1)D仪器的名称是___________ ,A中反应的化学方程式为___________ 。
(2)B中饱和食盐水的作用是___________ , 实验时C采用冰水浴的原因是___________ 。
(3)D中盛装的试剂可选用___________(双选,填选项字母)。
II.探究K2FeO4的性质
某研究性小组通过K2FeO4与Na2S的反应来探究K2FeO4的性质。
已知:①Fe2+遇铁氰化钾(K3[Fe(CN)6]) 溶液,可产生蓝色沉淀。
②BaS是黄色或黑红粉末,遇水逐渐水解为H2S和Ba (OH)2。
实验步骤如下:
(4)配平步骤1中反应的离子方程式___________
___________FeO +___________S2-+___________H+=___________Fe3++_________SO
+___________S2-+___________H+=___________Fe3++_________SO +20H2O
+20H2O
(5)步骤3中溶液变红的原因可能有两个:一是K2FeO4与Na2S 反应生成Fe3+,二是___________ (用文字作答)。
III.探究K2FeO4对有机污染物的去除效果
(6)对比K2FeO4、KMnO4、 FeCl3 三种物质对有机污染物去除效果如下图所示(三种试剂的初始浓度均为2.0 ×10-4mol·L-1)。

氧化阶段,去除有机污染物效果最差的试剂是___________ ; 絮凝阶段,几乎不具备絮凝能力的试剂是___________ 。综上分析,试剂___________ 兼具氧化性和絮凝性双重功效,是优异的有机污染物去除剂。
I.制备K2FeO4
实验室利用如图装置制备K2FeO4,其原理如下:3Cl2+ 2Fe (OH)3+ 10KOH= 2K2FeO4+ 6KCl+ 8H2O。

(1)D仪器的名称是
(2)B中饱和食盐水的作用是
(3)D中盛装的试剂可选用___________(双选,填选项字母)。
| A.NaCl | B.FeCl2 | C.H2SO4 | D.NaOH |
II.探究K2FeO4的性质
某研究性小组通过K2FeO4与Na2S的反应来探究K2FeO4的性质。
已知:①Fe2+遇铁氰化钾(K3[Fe(CN)6]) 溶液,可产生蓝色沉淀。
②BaS是黄色或黑红粉末,遇水逐渐水解为H2S和Ba (OH)2。
实验步骤如下:
| 步骤 | 操作 | 现象 |
| 1 | 取0.1mol·L-1的Na2S溶液2mL于试管中,滴加几滴0. 1mol·L-1的盐酸调至酸性,迅速加入少量K2FeO4固体,搅拌 | ___________ |
| 2 | 取步骤1中溶液,滴加K3[Fe (CN)6]溶液 | 无明显现象 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 溶液变红 |
| 4 | 取步骤1中溶液,滴加溶液BaCl2溶液 | 出现白色沉淀 |
___________FeO
 +___________S2-+___________H+=___________Fe3++_________SO
+___________S2-+___________H+=___________Fe3++_________SO +20H2O
+20H2O(5)步骤3中溶液变红的原因可能有两个:一是K2FeO4与Na2S 反应生成Fe3+,二是
III.探究K2FeO4对有机污染物的去除效果
(6)对比K2FeO4、KMnO4、 FeCl3 三种物质对有机污染物去除效果如下图所示(三种试剂的初始浓度均为2.0 ×10-4mol·L-1)。

氧化阶段,去除有机污染物效果最差的试剂是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水通过如下流程转化为粗As2O3。
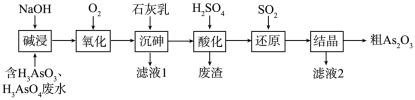
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4与NaOH反应可以生成_______ 种盐。
(2)“氧化”时,1 mol AsO 转化为AsO
转化为AsO 至少需要O2
至少需要O2_______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s) Ca2+(aq) + 2OH-(aq) ΔH <0
b.5Ca2+(aq)+ OH-(aq)+ 3AsO (aq) Ca5(AsO4)3OH(s) ΔH >0
(aq) Ca5(AsO4)3OH(s) ΔH >0
研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_______ 。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______ 。
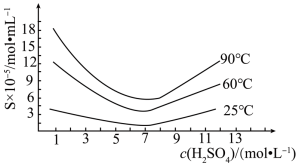
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”需要控制的具体条件是_______ 。
(6)下列说法中,正确的是_______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4与NaOH反应可以生成
(2)“氧化”时,1 mol AsO
 转化为AsO
转化为AsO 至少需要O2
至少需要O2(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s) Ca2+(aq) + 2OH-(aq) ΔH <0
b.5Ca2+(aq)+ OH-(aq)+ 3AsO
 (aq) Ca5(AsO4)3OH(s) ΔH >0
(aq) Ca5(AsO4)3OH(s) ΔH >0研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”需要控制的具体条件是

(6)下列说法中,正确的是
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.下表是某儿童在哈尔滨市医疗机构临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童_______ 元素含量偏低(填元素名称)。
(2)报告单中“mol·L-1”是_______ (填“质量”、“体积”或“浓度”)的单位。
(3)检测儿童的血液中钙的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,钙的正常含量参考范围是1.55~2.10 mmol/L。如果以“mg/dL”表示,钙的正常含量参考范围是_______ ?(计算结果保留两位小数)
Ⅱ.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
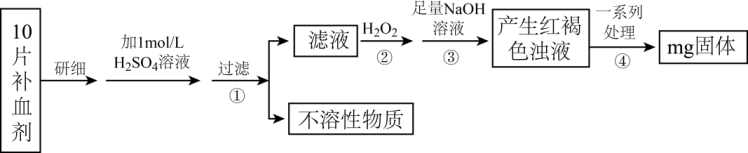
请回答下列问题:
(4)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_______ (填离子符号)。
(5)步骤②加入过量H2O2的目的是_______ 。步骤②反应的离子方程式为_______
(6)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______ g。服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的_______ 。(填“氧化性”或“还原性”)。
(7)由FeSO4·7H2O配制450mL1mol/L FeSO4溶液,需要的玻璃仪器有玻璃棒、_______
(8)以下操作会导致所配溶液浓度偏低的是_______ 。(填序号)
A.称取敞放空气中的FeSO4·7H2O
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(9)若向FeSO4溶液中加入足量Na2O2,观察到的现象是_______
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | Zn | 115.92 | mol·L-l | 66-120 |
| 2 | Fe | 6.95 | mmol·L-1 | 7.52-11.82 |
| 3 | Ca | 1.78 | mmol·L-1 | 1.55-2.10 |
(1)该儿童
(2)报告单中“mol·L-1”是
(3)检测儿童的血液中钙的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,钙的正常含量参考范围是1.55~2.10 mmol/L。如果以“mg/dL”表示,钙的正常含量参考范围是
Ⅱ.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(4)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有
(5)步骤②加入过量H2O2的目的是
(6)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
(7)由FeSO4·7H2O配制450mL1mol/L FeSO4溶液,需要的玻璃仪器有玻璃棒、
(8)以下操作会导致所配溶液浓度偏低的是
A.称取敞放空气中的FeSO4·7H2O
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(9)若向FeSO4溶液中加入足量Na2O2,观察到的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、极易水解,可用作肥料、灭火剂、洗涤剂等。实验室用如图所示装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。

(1)结合上述实验装置,写出制备氨基甲酸铵的化学方程式:_____ 。该反应为_____ (填“吸热”或“放热”)反应。
(2)液体石蜡鼓泡瓶的作用是_____ ,冰水的作用是_____ 。
(3)从反应后的混合物中分离出产品的实验方法是_____ 。
(4)氨基甲酸铵极易水解,产物是碳酸氢铵和一种弱碱,请写出其水解反应方程式:_____ 。
(5)某实验小组通过上述实验装置进行实验,得到了一份只含有少量碳酸铵杂质的氨基甲酸铵固体产品。为验证氨基甲酸铵的水解产物有 ,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,
,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,_____ 。(限选试剂:蒸馏水、BaCl2溶液、澄清石灰水、AgNO3溶液)
(6)氨基甲酸铵可用作肥料,其肥效比尿素_____ (填“强”或“弱”)。

(1)结合上述实验装置,写出制备氨基甲酸铵的化学方程式:
(2)液体石蜡鼓泡瓶的作用是
(3)从反应后的混合物中分离出产品的实验方法是
(4)氨基甲酸铵极易水解,产物是碳酸氢铵和一种弱碱,请写出其水解反应方程式:
(5)某实验小组通过上述实验装置进行实验,得到了一份只含有少量碳酸铵杂质的氨基甲酸铵固体产品。为验证氨基甲酸铵的水解产物有
 ,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,
,该实验小组计划用上述样品进行实验。请补充以下实验设计方案:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,(6)氨基甲酸铵可用作肥料,其肥效比尿素
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: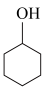
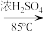
 +H2O
+H2O
(1)制备粗品:采用如图所示装置,用环己醇制备环己烯。
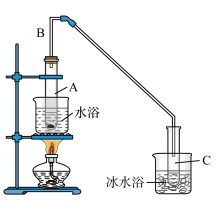
将10.0g环己醇加入试管A中,再加入1mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是______ 。
②试管C置子冰水浴中的目的是_____ 。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______ 层(填“上”或“下),分液后用______ 洗涤(填字母)。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按如图装置蒸馏。冷凝水从_____ 口进入(填“g”或“f”)。
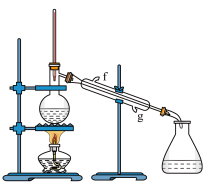
③收集产品时,应收集______ ℃的馏分,若最终收集到环己烯5.74g,则产率为______ 。
已知:

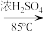
 +H2O
+H2O| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | 摩尔质量(g/mol) | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 | 100 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 | 82 |

将10.0g环己醇加入试管A中,再加入1mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是
②试管C置子冰水浴中的目的是
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按如图装置蒸馏。冷凝水从

③收集产品时,应收集
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】六氯化钨( )可用作有机合成催化剂,熔点为
)可用作有机合成催化剂,熔点为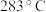 ,沸点为
,沸点为 ,易溶于
,易溶于 ,极易水解。实验室中,先将三氧化钨(
,极易水解。实验室中,先将三氧化钨( )还原为金属钨(W)再制备
)还原为金属钨(W)再制备 ,装置如图所示(夹持装置略)。回答下列问题:
,装置如图所示(夹持装置略)。回答下列问题:
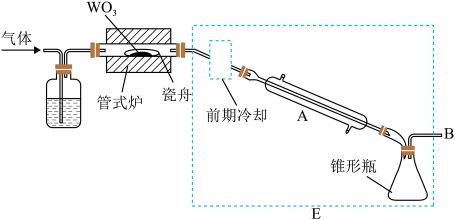
(1)检查装置气密性并加入 。先通
。先通 ,其目的是
,其目的是____________ ;一段时间后,加热管式炉,改通 ,对B处逸出的
,对B处逸出的 进行后续处理。仪器A的名称为
进行后续处理。仪器A的名称为____________ ,证明 已被完全还原的现象是
已被完全还原的现象是____________ 。
(2) 完全还原后,进行的操作为:①冷却,停止通
完全还原后,进行的操作为:①冷却,停止通 ;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通
;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通 ;⑥……
;⑥……
碱石灰的作用是____________ ;操作④是____________ ,目的是____________ 。
 )可用作有机合成催化剂,熔点为
)可用作有机合成催化剂,熔点为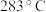 ,沸点为
,沸点为 ,易溶于
,易溶于 ,极易水解。实验室中,先将三氧化钨(
,极易水解。实验室中,先将三氧化钨( )还原为金属钨(W)再制备
)还原为金属钨(W)再制备 ,装置如图所示(夹持装置略)。回答下列问题:
,装置如图所示(夹持装置略)。回答下列问题:
(1)检查装置气密性并加入
 。先通
。先通 ,其目的是
,其目的是 ,对B处逸出的
,对B处逸出的 进行后续处理。仪器A的名称为
进行后续处理。仪器A的名称为 已被完全还原的现象是
已被完全还原的现象是(2)
 完全还原后,进行的操作为:①冷却,停止通
完全还原后,进行的操作为:①冷却,停止通 ;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通
;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通 ;⑥……
;⑥……碱石灰的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果。实现了废水处理过程的“三废”零排放。其主要工艺流程如下:

已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为________ ,通过与石灰发生________ 反应(填基本反应类型)被吸收。
(2)写出一级沉砷过程中生成雌黄的离子方程式:_______________________________ 。
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质_________________________ 。
(4)二级沉砷过程中使用双氧水的目的有______________ 。
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH)3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:______________________________
(6)滤渣B的主要成分有__________________________ (写两种,用化学式表示)。

已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为
(2)写出一级沉砷过程中生成雌黄的离子方程式:
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质
(4)二级沉砷过程中使用双氧水的目的有
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH)3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:
(6)滤渣B的主要成分有
您最近一年使用:0次
【推荐2】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
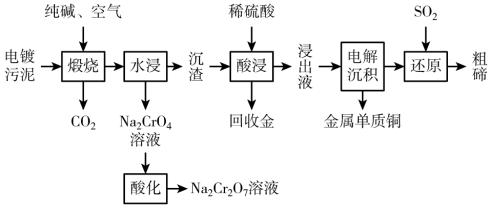
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为___________ 。
(2)为提高酸浸速率,可采用的措施是___________ (任写一条)。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有___________ (写化学式)。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O 和CrO
和CrO 相互转化的平衡,请用离子方程式表示它们之间的转化反应
相互转化的平衡,请用离子方程式表示它们之间的转化反应___________ 。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为___________ 。(写化学式)。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O 被还原为Cr3+)
被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为___________ 。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为___________ %。[已知M(K2Cr2O7)=294g·mol-1,计算结果保留三位有效数字]
(6)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?___________ (填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)煅烧时,Cr2O3发生反应的化学方程式为
(2)为提高酸浸速率,可采用的措施是
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O
 和CrO
和CrO 相互转化的平衡,请用离子方程式表示它们之间的转化反应
相互转化的平衡,请用离子方程式表示它们之间的转化反应②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O
 被还原为Cr3+)
被还原为Cr3+)①氧化还原滴定过程中的离子方程式为
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为
(6)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】二草酸合铜(Ⅱ)酸钾( )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是________ (填仪器名称)。

(2)长期存放的 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是________ 。
(3)Ⅰ中的黑色沉淀是________ (写化学式)。
(4)Ⅱ中原料配比为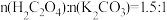 ,写出反应的化学方程式
,写出反应的化学方程式________ 。
(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入 应采取
应采取________ 的方法。
(6)Ⅲ中应采用________ 进行加热。
(7)Ⅳ中“一系列操作”包括________ 。
 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)由
 配制Ⅰ中的
配制Ⅰ中的 溶液,下列仪器中不需要的是
溶液,下列仪器中不需要的是
(2)长期存放的
 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是(3)Ⅰ中的黑色沉淀是
(4)Ⅱ中原料配比为
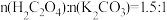 ,写出反应的化学方程式
,写出反应的化学方程式(5)Ⅱ中,为防止反应过于剧烈而引起喷溅,加入
 应采取
应采取(6)Ⅲ中应采用
(7)Ⅳ中“一系列操作”包括
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】四水合磷酸锌[Zn3(PO4)2•4H2O,难溶于水]是一种性能优良的绿色环保防锈颜料.实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2•4H2O的流程如图,回答下列问题:
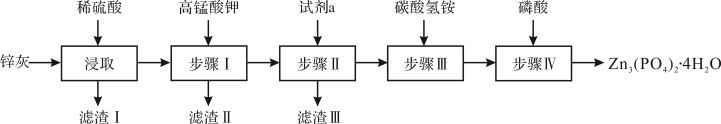
(1)基态Zn2+的价电子排布式为_____ 。
(2)滤渣I的主要成分为____ 。
(3)步骤I除铁操作中,需先将溶液的pH调至5.1,再滴加KMnO4溶液(还原产物是MnO2,该反应的离子方程式为____ 。
(4)已知:步骤IV发生的反应为3[2ZnCO3•3Zn(OH)2•2H2O]+10H3PO4=5[Zn3(PO4)2•4H2O]+6CO2↑+10H2O,步骤III加入NH4HCO3发生反应的化学方程式为____ 。
(5)步骤IV反应结束后,得到Zn3(PO4)2•4H2O的操作包括____ 和干燥。
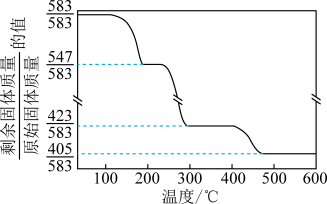
(6)2ZnCO3•3Zn(OH)2•2H2O加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有____ 。(填化学式)

(1)基态Zn2+的价电子排布式为
(2)滤渣I的主要成分为
(3)步骤I除铁操作中,需先将溶液的pH调至5.1,再滴加KMnO4溶液(还原产物是MnO2,该反应的离子方程式为
(4)已知:步骤IV发生的反应为3[2ZnCO3•3Zn(OH)2•2H2O]+10H3PO4=5[Zn3(PO4)2•4H2O]+6CO2↑+10H2O,步骤III加入NH4HCO3发生反应的化学方程式为
(5)步骤IV反应结束后,得到Zn3(PO4)2•4H2O的操作包括
(6)2ZnCO3•3Zn(OH)2•2H2O加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有

您最近一年使用:0次
【推荐2】化工生产中常用各种铝矿石来制备含铝化合物。I.铝元素在自然界中主要存在于铝土矿 主要成分为
主要成分为 ,还含有
,还含有 、FeO、
、FeO、 中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

已知:在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
 滤液B中含有的离子有
滤液B中含有的离子有_________ :检验滤液B中是否还含有铁元素的试剂为:_________
 将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________  填代号
填代号 。
。
 氢氧化钠溶液
氢氧化钠溶液  硫酸溶液
硫酸溶液  氨水
氨水  二氧化碳
二氧化碳
 由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边
由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边________  填操作名称
填操作名称 、过滤、洗涤。
、过滤、洗涤。
 高铁酸钠
高铁酸钠 是一种强氧化剂,可作为水处理剂和高容量电池材料。
是一种强氧化剂,可作为水处理剂和高容量电池材料。 与漂白液
与漂白液 主要成分
主要成分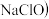 在强碱性条件下反应可制取
在强碱性条件下反应可制取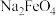 ,反应的离子方程式为
,反应的离子方程式为_______ 。
 以高硫铝土矿
以高硫铝土矿 主要成分为
主要成分为 、
、 、
、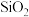 ,少量
,少量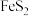 和金属硫酸盐
和金属硫酸盐 为原料,生产氧化铝并获得
为原料,生产氧化铝并获得 的部分工艺流程如下:
的部分工艺流程如下:

 焙烧过程均会产生
焙烧过程均会产生 ,用NaOH溶液吸收过量
,用NaOH溶液吸收过量 的离子方程式为
的离子方程式为__________ 。
 向“过滤”得到的滤液中通入过量
向“过滤”得到的滤液中通入过量 ,铝元素存在的形式由
,铝元素存在的形式由_______  填化学式
填化学式 转化为
转化为______  填化学式
填化学式 。
。
 “过滤”得到的滤渣中含大量的
“过滤”得到的滤渣中含大量的 。
。 与
与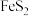 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成 和
和 ,理论上完全反应消耗的
,理论上完全反应消耗的
_____ 。
 主要成分为
主要成分为 ,还含有
,还含有 、FeO、
、FeO、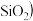 中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
已知:在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
 滤液B中含有的离子有
滤液B中含有的离子有 将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 填代号
填代号 。
。 氢氧化钠溶液
氢氧化钠溶液  硫酸溶液
硫酸溶液  氨水
氨水  二氧化碳
二氧化碳 由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边
由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边 填操作名称
填操作名称 、过滤、洗涤。
、过滤、洗涤。 高铁酸钠
高铁酸钠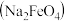 是一种强氧化剂,可作为水处理剂和高容量电池材料。
是一种强氧化剂,可作为水处理剂和高容量电池材料。 与漂白液
与漂白液 主要成分
主要成分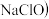 在强碱性条件下反应可制取
在强碱性条件下反应可制取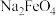 ,反应的离子方程式为
,反应的离子方程式为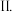 以高硫铝土矿
以高硫铝土矿 主要成分为
主要成分为 、
、 、
、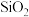 ,少量
,少量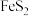 和金属硫酸盐
和金属硫酸盐 为原料,生产氧化铝并获得
为原料,生产氧化铝并获得 的部分工艺流程如下:
的部分工艺流程如下:
 焙烧过程均会产生
焙烧过程均会产生 ,用NaOH溶液吸收过量
,用NaOH溶液吸收过量 的离子方程式为
的离子方程式为 向“过滤”得到的滤液中通入过量
向“过滤”得到的滤液中通入过量 ,铝元素存在的形式由
,铝元素存在的形式由 填化学式
填化学式 转化为
转化为 填化学式
填化学式 。
。 “过滤”得到的滤渣中含大量的
“过滤”得到的滤渣中含大量的 。
。 与
与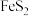 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成 和
和 ,理论上完全反应消耗的
,理论上完全反应消耗的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】锗是重要的半导体材料,但Ge是地球上最分散的元素之一,被称为“稀散金属”。现利用云南临沧地区富锗的褐煤矿(锗质量分数约为0.01%~0.05%)提取高纯二氧化锗,其工艺流程如图所示:
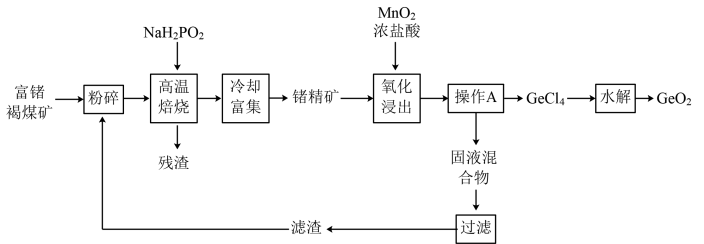
已知含锗化合物的物理性质如下表:
回答下列问题:
(1)Ge的原子序数为32,Ge在元素周期表中的位置是_______ 。
(2)对富锗褐煤矿进行“粉碎”的目的是_______ 。
(3)高温焙烧过程中, 可将
可将 转化为GeO,同时生成
转化为GeO,同时生成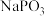 ,试写出该转化过程的化学方程式
,试写出该转化过程的化学方程式_______ 。高温焙烧过程中加入 的目的是
的目的是_______ 。
(4)在“氧化浸出”过程中,反应温度过高时发生的副反应的离子方程式为_______ 。
(5)“氧化浸出”过程中加入过量浓盐酸,其作用除了可以将 转化为
转化为 外,还能
外,还能_______ ,从而提高 的产率。
的产率。
(6)操作A的名称为_______ 。

已知含锗化合物的物理性质如下表:
| 物质 | GeO |  |  |
| 熔点/℃ | 700(升华) | 1116 |  |
| 沸点/℃ | - | 1200 | 86.5 |
回答下列问题:
(1)Ge的原子序数为32,Ge在元素周期表中的位置是
(2)对富锗褐煤矿进行“粉碎”的目的是
(3)高温焙烧过程中,
 可将
可将 转化为GeO,同时生成
转化为GeO,同时生成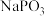 ,试写出该转化过程的化学方程式
,试写出该转化过程的化学方程式 的目的是
的目的是(4)在“氧化浸出”过程中,反应温度过高时发生的副反应的离子方程式为
(5)“氧化浸出”过程中加入过量浓盐酸,其作用除了可以将
 转化为
转化为 外,还能
外,还能 的产率。
的产率。(6)操作A的名称为
您最近一年使用:0次



