名校
解题方法
1 . 某同学利用实验室中几种等浓度(相同体积的溶液里含相同数目的溶质)溶液:
①NaOH溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液,进行以下实验。
溶液,进行以下实验。
(1)将表格补充完整。a___________ b___________
(2)该同学认为从理论上即可推测①与④不反应,依据是:___________
(3)写出②与④发生反应的离子反应方程式:___________
(4)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的四种溶液设计了简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入1mL②,___________ (从操作、现象、结论方面描述)。
①NaOH溶液 ②
 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液,进行以下实验。
溶液,进行以下实验。| 序号 | 操作 | 现象 | 离子方程式 |
| ⅰ | 向盛有2mL①的试管中加入1mL③ | 产生蓝色沉淀 | a |
| ⅱ | 向盛有2mL②的试管中加入1mL④ | b |
(2)该同学认为从理论上即可推测①与④不反应,依据是:
(3)写出②与④发生反应的离子反应方程式:
(4)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的四种溶液设计了简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入1mL②,
您最近半年使用:0次
名校
解题方法
2 . “价-类”二维图是我们认识物质性质、实现物质转化的重要工具,钠及其化合物的“价-类”二维图及部分转化关系如图所示,其中B为钠的另一种氧化物。

(1)B为___________ ,属于___________ (填“酸性氧化物”、“碱性氧化物”、“两性氧化物”);
(2)上述反应中属于氧化还原反应的是___________ (填序号);
(3)请写出②的离子方程式___________ ;
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
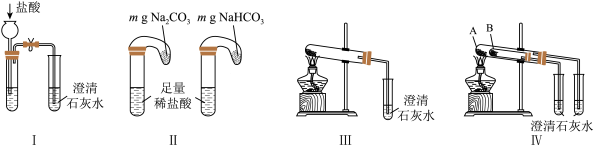
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是___________ (填装置序号),对应的现象是___________ 。
②Ⅳ可用来鉴别Na2CO3和NaHCO3的稳定性,其中B中装的是___________ ,Ⅳ中受热处发生反应的化学方程式:___________ 。

(1)B为
(2)上述反应中属于氧化还原反应的是
(3)请写出②的离子方程式
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是
②Ⅳ可用来鉴别Na2CO3和NaHCO3的稳定性,其中B中装的是

您最近半年使用:0次
解题方法
3 . 用NaOH固体配制220 mL0.2 mol/L的溶液。请回答。
(1)在配制过程中除了烧杯、玻璃棒外,还简要的玻璃仪器是_______ 。
(2)用托盘天平称量时,简要NaOH固体的质量是_______ 。
(3)定容时的操作:当液面接近容量瓶刻度线时,_______ ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)下列操作会使配得的NaOH溶液浓度偏低的是_______
A.称取相同质量已部分变质的NaOH固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
E.转移溶液前容量瓶中有少量蒸馏水
(5)将标况下896 mLCO2气体通入上述配制好的全部溶液中,发生的化学反应方程式是_____ 。
(1)在配制过程中除了烧杯、玻璃棒外,还简要的玻璃仪器是
(2)用托盘天平称量时,简要NaOH固体的质量是
(3)定容时的操作:当液面接近容量瓶刻度线时,
(4)下列操作会使配得的NaOH溶液浓度偏低的是
A.称取相同质量已部分变质的NaOH固体进行配制
B.定容时俯视容量瓶的刻度线
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
E.转移溶液前容量瓶中有少量蒸馏水
(5)将标况下896 mLCO2气体通入上述配制好的全部溶液中,发生的化学反应方程式是
您最近半年使用:0次
名校
解题方法
4 . 2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。
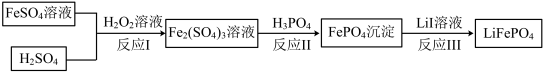
已知:H3PO4能电离出 。
。
(1)Li在元素周期表中的位置是___________ 。
(2)LiFePO4中,Fe元素的化合价为___________ 。
(3)反应I的离子方程式是___________ 。
(4)反应III的化学方程式是___________ 。

已知:H3PO4能电离出
 。
。(1)Li在元素周期表中的位置是
(2)LiFePO4中,Fe元素的化合价为
(3)反应I的离子方程式是
(4)反应III的化学方程式是
您最近半年使用:0次
解题方法
5 . 为除去粗盐中的Ca2+、Mg2+、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐
 滤液
滤液 粗盐
粗盐
(1)第①步中,操作A是_________ ,第⑤步中,操作B是_________ 。
(2)第④步中,写出相应的离子方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)__________________ ,______________________ 。
(3)若先用盐酸调pH调至中性,再过滤,将对实验结果产生影响,其原因是_____________________ 。
(4)判断BaCl2已过量的方法是__________________________________________ 。
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐
 滤液
滤液 粗盐
粗盐(1)第①步中,操作A是
(2)第④步中,写出相应的离子方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若先用盐酸调pH调至中性,再过滤,将对实验结果产生影响,其原因是
(4)判断BaCl2已过量的方法是
您最近半年使用:0次
解题方法
6 . 现有下列电解质:①稀硫酸②冰醋酸③Ba(OH)2④石炭酸⑤氨水⑥NaHSO4⑦盐酸⑧明矾⑨钾钠合金。
(1)(用序号填空)其中可以导电的有___ ,属于弱电解质的是____ ,属于盐的有___ 。
(2)写出⑥在融化状态下的电离方程式:______ 。
(3)写出将③的水溶液逐滴加入到一定量的⑧溶液中至沉淀质量最大时的离子方程式:___ 。
(1)(用序号填空)其中可以导电的有
(2)写出⑥在融化状态下的电离方程式:
(3)写出将③的水溶液逐滴加入到一定量的⑧溶液中至沉淀质量最大时的离子方程式:
您最近半年使用:0次
名校
解题方法
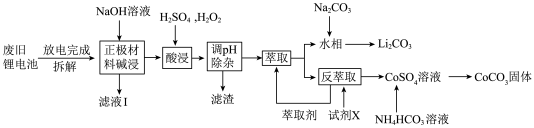
7 . 钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5 mo/L)的pH如下表:
回答下列问题:
(1)滤液Ⅰ的主要成分是_________ 。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是________ 不能用盐酸代替硫酸,原因是:_________ 。“调节pH”除去的离子主要有Al3+和_____ 。
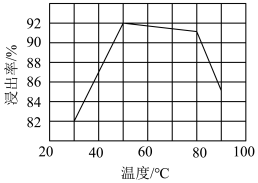
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是_________ 。
(4)“萃取”和“反萃取“可简单表示为:Co2++2(HA)2 Co(HA2)2+2H+,则反萃取过程加入的试剂X是
Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________ 。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为_____ 。

几种金属离子沉淀完全(离子浓度为10-5 mo/L)的pH如下表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)滤液Ⅰ的主要成分是
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是

(4)“萃取”和“反萃取“可简单表示为:Co2++2(HA)2
 Co(HA2)2+2H+,则反萃取过程加入的试剂X是
Co(HA2)2+2H+,则反萃取过程加入的试剂X是(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为
您最近半年使用:0次



