解题方法
1 . 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将100mL 盐酸与100mL
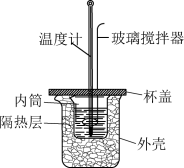
盐酸与100mL NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相等)。回答下列问题:
NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相等)。回答下列问题:

(1)从实验装置上看,图中缺少的一种玻璃仪器是_______ ,其作用是_______ 。
(2)简易量热计如果不盖杯盖,生成1mol 时所测得中和反应的反应热(
时所测得中和反应的反应热( )将
)将_______ (填“偏大”、“偏小”或“不变”)。
(3)实验中改用60mL 盐酸和60mL
盐酸和60mL NaOH溶液进行反应,与上述实验相比,二者所放出的热量
NaOH溶液进行反应,与上述实验相比,二者所放出的热量_______ (填“相等”或“不相等”)。
(4)若用等体积、等物质的量浓度的 进行上述实验,生成1mol
进行上述实验,生成1mol 时,所测得的中和反应的反应热(
时,所测得的中和反应的反应热( )的绝对值将
)的绝对值将_______ (填“偏大”“偏小”或“无影响”)。
(5)下列说法正确的是_______ (填标号)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁,将剩余的稀盐酸转移至内筒中,以免造成测量误差
c.用量筒量取稀酸或稀碱时,视线必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1mol 时所测得的中和反应的反应热(
时所测得的中和反应的反应热( )无影响
)无影响
 盐酸与100mL
盐酸与100mL NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相等)。回答下列问题:
NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相等)。回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是
(2)简易量热计如果不盖杯盖,生成1mol
 时所测得中和反应的反应热(
时所测得中和反应的反应热( )将
)将(3)实验中改用60mL
 盐酸和60mL
盐酸和60mL NaOH溶液进行反应,与上述实验相比,二者所放出的热量
NaOH溶液进行反应,与上述实验相比,二者所放出的热量(4)若用等体积、等物质的量浓度的
 进行上述实验,生成1mol
进行上述实验,生成1mol 时,所测得的中和反应的反应热(
时,所测得的中和反应的反应热( )的绝对值将
)的绝对值将(5)下列说法正确的是
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁,将剩余的稀盐酸转移至内筒中,以免造成测量误差
c.用量筒量取稀酸或稀碱时,视线必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1mol
 时所测得的中和反应的反应热(
时所测得的中和反应的反应热( )无影响
)无影响
您最近一年使用:0次
2 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 gNaHCO3固体,再分别加入30 mL 0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_____ (填“甲”或“乙”) ,理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______________ 。
②表格二对应实验得出的结论是________________ 。
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1______ (填“>”、“< ”或“=”,下同) △H3,△H2______ △H4。
 (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
A.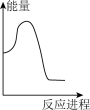 | B.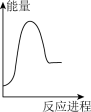 | C.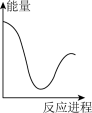 | D.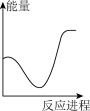 |

表格一:
试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
表格二:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22. 3 | 19.0 | 10mL H2O 19.0 | 19.0 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL H2O 19.0 | 19.0 |
表格三:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22.3 | 19.0 | 10mL HCl 19.0 | 20.5 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL HCl19.0 | 18.3 |
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1
您最近一年使用:0次
3 . 实验室利用如图装置进行中和热的测定。回答下列问题:
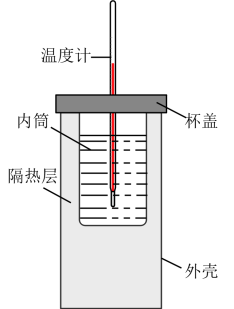
(1)图中还缺少一个玻璃仪器,名称为:___________ 。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L−1的稀盐酸恰好完全反应,其反应热分别为∆H1、∆H2、∆H3,则∆H1、∆H2、∆H3的大小关系为___________ 。
(3)用50 mL0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液反应,实验中测得起始温度为20.1℃,终止温度为23.4℃,反应后溶液的比热容为4.18 J/(g·℃),盐酸和NaOH溶液的密度都近似认为是1g·cm3,则计算出的中和热∆H =___________ 。

(1)图中还缺少一个玻璃仪器,名称为:
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L−1的稀盐酸恰好完全反应,其反应热分别为∆H1、∆H2、∆H3,则∆H1、∆H2、∆H3的大小关系为
(3)用50 mL0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液反应,实验中测得起始温度为20.1℃,终止温度为23.4℃,反应后溶液的比热容为4.18 J/(g·℃),盐酸和NaOH溶液的密度都近似认为是1g·cm3,则计算出的中和热∆H =
您最近一年使用:0次
2021-12-04更新
|
131次组卷
|
2卷引用:辽宁省辽河油田第一高级中学2020-2021学年高一(A部)下学期期中考试化学试题
名校
解题方法
4 . 如图是某实验小组改进的中和热测定实验装置。在塑料瓶中事先加入50 mL  盐酸,然后通过注射器注入50 mL
盐酸,然后通过注射器注入50 mL
 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
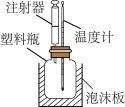
(1)塑料瓶外泡沫板的作用是___________ 。
(2)该实验中 过量的目的是
过量的目的是___________ 。
(3)实验小组按课本装置和改进后的装置分别进行实验,测得实验数据如下:
表中记录的终止温度是指___________ ,根据改进后装置的实验数据计算中和热
___________ (计算结果保留两位小数,近似认为盐酸和 溶液的密度都是
溶液的密度都是 ,中和后溶液的比热容
,中和后溶液的比热容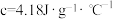 )
)
(4)有同学考虑注射器针筒中会有 溶液残留(不超过0.5mL),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:
溶液残留(不超过0.5mL),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:___________ 。
(5)如果用60 mL 盐酸与60 mL
盐酸与60 mL 
 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”或“不相等”,下同),所求中和热___________ 。
(6)醋酸和 的中和反应反应热数值与盐酸和
的中和反应反应热数值与盐酸和 的中和反应反应热数值相比,
的中和反应反应热数值相比,___________ (填“醋酸”或“盐酸”)的 较大,原因是
较大,原因是___________ 。
 盐酸,然后通过注射器注入50 mL
盐酸,然后通过注射器注入50 mL
 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
(1)塑料瓶外泡沫板的作用是
(2)该实验中
 过量的目的是
过量的目的是(3)实验小组按课本装置和改进后的装置分别进行实验,测得实验数据如下:
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差( )/℃ )/℃ | |||||||
 |  | 平均值 | ||||||||
| 改进前 | 改进后 | 改进前 | 改进后 | 改进前 | 改进后 | 改进前 | 改进后 | 改进前 | 改进后 | |
| 1 | 19.1 | 19.0 | 21.1 | 21.2 | 20.1 | 20.2 | 23.4 | 23.6 | 3.3 | 3.4 |
| 2 | 19.0 | 19.2 | 21.0 | 20.8 | 20.0 | 20.0 | 23.2 | 23.5 | 3.2 | 3.5 |
| 3 | 19.2 | 19.2 | 21.2 | 21.0 | 20.2 | 20.1 | 23.6 | 23.4 | 3.4 | 3.3 |

 溶液的密度都是
溶液的密度都是 ,中和后溶液的比热容
,中和后溶液的比热容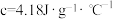 )
)(4)有同学考虑注射器针筒中会有
 溶液残留(不超过0.5mL),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:
溶液残留(不超过0.5mL),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:(5)如果用60 mL
 盐酸与60 mL
盐酸与60 mL 
 溶液进行反应,与上述实验相比,所放出的热量
溶液进行反应,与上述实验相比,所放出的热量(6)醋酸和
 的中和反应反应热数值与盐酸和
的中和反应反应热数值与盐酸和 的中和反应反应热数值相比,
的中和反应反应热数值相比, 较大,原因是
较大,原因是
您最近一年使用:0次



