1 . 合成氨的反应为N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:
2NH3(g)ΔH=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:
(1)如果将1mol氮气和3mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?___________ 。
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,充入2mol氮气和3mol氢气,反应经过2分钟后,容器内压强变为原来的 ,则0~2分钟内用氮气表示的化学反应速率是
,则0~2分钟内用氮气表示的化学反应速率是___________ ,此时氢气的转化率为___________ 。
(3)在容积为2L的密闭容器内,充入1mol氮气和3mol氢气,在500℃、有催化剂作用条件下,当合成氨的反应达到化学平衡时,下列说法正确的是___________ 。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.NH3的体积分数保持不变 f.反应达到该条件下的最大限度
(4)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗9.95gCuCl(s)放热4.44kJ,该反应的热化学方程式是___________ 。
(5)根据所学知识,比较下列反应热的大小。
①同一反应的生成物状态不同时反应热不同,如2H2(g)+O2(g)=2H2O(g) ΔH1,2H2(g)+O2(g)=2H2O(l) ΔH2,则ΔH1___________ ΔH2(填“>”、“<”或“=”,下同)。
②同一反应的反应物状态不同时,反应热不同,如S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1___________ ΔH2。
 2NH3(g)ΔH=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:
2NH3(g)ΔH=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:(1)如果将1mol氮气和3mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,充入2mol氮气和3mol氢气,反应经过2分钟后,容器内压强变为原来的
 ,则0~2分钟内用氮气表示的化学反应速率是
,则0~2分钟内用氮气表示的化学反应速率是(3)在容积为2L的密闭容器内,充入1mol氮气和3mol氢气,在500℃、有催化剂作用条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.NH3的体积分数保持不变 f.反应达到该条件下的最大限度
(4)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗9.95gCuCl(s)放热4.44kJ,该反应的热化学方程式是
(5)根据所学知识,比较下列反应热的大小。
①同一反应的生成物状态不同时反应热不同,如2H2(g)+O2(g)=2H2O(g) ΔH1,2H2(g)+O2(g)=2H2O(l) ΔH2,则ΔH1
②同一反应的反应物状态不同时,反应热不同,如S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1
您最近一年使用:0次
2 . I.某实验小组用100 mL 0.55mol·L-1 NaOH溶液与100mL0.5 mol·L-1盐酸进行中和热的测定。装置如图所示。

(1)回答下列问题:
①图中装置缺少的仪器是_______ 。
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1_______ ΔH(填写< 、>、=);若测得该反应放出的热量为2.865 kJ,请写出盐酸与 NaOH溶液反应的中和热的热化学方程式:_______
Ⅱ.已知1g的甲烷完全燃烧生成液态水放出akJ的热量
(2)写出表示甲烷燃烧热的热化学方程式为_______ 。
Ⅲ.已知下列两个热化学方程式:
H2(g)+ O2(g)=H2O(l) ΔH=-286.0 kJ/mol
O2(g)=H2O(l) ΔH=-286.0 kJ/mol
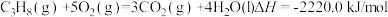 C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol
(3)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热5298kJ,则混合气体中H2和C3H8的体积比为_______ 。
(4)已知: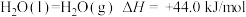 H2O(l) =H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式:
H2O(l) =H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式:_______ 。

(1)回答下列问题:
①图中装置缺少的仪器是
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ.已知1g的甲烷完全燃烧生成液态水放出akJ的热量
(2)写出表示甲烷燃烧热的热化学方程式为
Ⅲ.已知下列两个热化学方程式:
H2(g)+
 O2(g)=H2O(l) ΔH=-286.0 kJ/mol
O2(g)=H2O(l) ΔH=-286.0 kJ/mol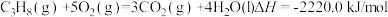 C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol(3)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热5298kJ,则混合气体中H2和C3H8的体积比为
(4)已知:
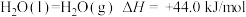 H2O(l) =H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式:
H2O(l) =H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下。
 (M)
(M)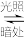
 (N)
(N) 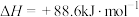
则M的化学式为,M、N相比,较稳定的是___________ (填“M”或“N”)。
(2)已知 (1)的燃烧热为
(1)的燃烧热为 ,
,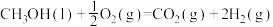

 ,则a
,则a___________ 238.6(填“>”“<”或“=”)。
(3)使 和
和 (g)通过灼热的炭层,生成HCl和
(g)通过灼热的炭层,生成HCl和 ,当有1mol
,当有1mol  参与反应时释放出145kJ热量,写出该反应的热化学方程式:
参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
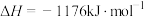 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为___________ 。
(5)已知:
①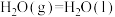
 ;
;
②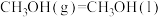
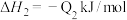 ;
;
③
 (
( 、
、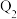 、
、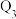 均大于0)。
均大于0)。
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为___________ kJ。
(1)有机物M经过太阳光光照可转化成N,转化过程如下。
 (M)
(M)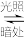
 (N)
(N) 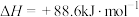
则M的化学式为,M、N相比,较稳定的是
(2)已知
 (1)的燃烧热为
(1)的燃烧热为 ,
,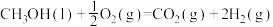

 ,则a
,则a(3)使
 和
和 (g)通过灼热的炭层,生成HCl和
(g)通过灼热的炭层,生成HCl和 ,当有1mol
,当有1mol  参与反应时释放出145kJ热量,写出该反应的热化学方程式:
参与反应时释放出145kJ热量,写出该反应的热化学方程式:(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,

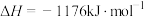 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为(5)已知:
①
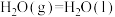
 ;
;②
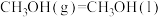
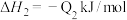 ;
;③

 (
( 、
、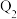 、
、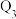 均大于0)。
均大于0)。若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为
您最近一年使用:0次
2022-03-22更新
|
421次组卷
|
4卷引用:内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题
内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题(已下线)1.2 反应热的计算-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省襄阳市第三中学2022-2023学年高二上学期12月月考化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题
4 . 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热ΔH=___________ 。
(2)今有如下两个热化学方程式:则a___________ b(填>,=,<)
H2(g)+ O2(g)=H2O(g) ΔH1=akJ·mol -1
O2(g)=H2O(g) ΔH1=akJ·mol -1
H2(g)+ O2(g)=H2O(l) ΔH2=bkJ·mol -1
O2(g)=H2O(l) ΔH2=bkJ·mol -1
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ·mol -1 。试根据表中所列键能数据估算a的值:
2NH3(g) △H=a kJ·mol -1 。试根据表中所列键能数据估算a的值:___________ 。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol -1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol -1
2C2H2(g)+5O2(g)=4CO2(g)+2H 2O(l) △H3=-2599kJ·mol -1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1molC2H2(g)反应的反应热△H=___________ 。
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热ΔH=
(2)今有如下两个热化学方程式:则a
H2(g)+
 O2(g)=H2O(g) ΔH1=akJ·mol -1
O2(g)=H2O(g) ΔH1=akJ·mol -1 H2(g)+
 O2(g)=H2O(l) ΔH2=bkJ·mol -1
O2(g)=H2O(l) ΔH2=bkJ·mol -1(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2(g)+3H2(g)
 2NH3(g) △H=a kJ·mol -1 。试根据表中所列键能数据估算a的值:
2NH3(g) △H=a kJ·mol -1 。试根据表中所列键能数据估算a的值:| 化学键 | H-H | N-H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol -1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol -1
2C2H2(g)+5O2(g)=4CO2(g)+2H 2O(l) △H3=-2599kJ·mol -1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1molC2H2(g)反应的反应热△H=
您最近一年使用:0次
2021-10-23更新
|
188次组卷
|
2卷引用:天津市宝坻区大钟庄高级中学2021-2022学年高二上学期第一次月考化学试题
5 . I.丙烷燃烧可以通过以下两种途径:
途径 I:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ∆H=-a kJ·mol-1
途径 II:C3H8(g)=C3H6(g)+H2(g) ∆H=+b kJ·mol-1
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ∆H=-d kJ·mol-1(a、b、c、d 均为正值)
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______ (填“大于”、“等于” 或“小于”)途径II放出的热量。
II.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50mL 0.50mol·L-1盐酸倒入小烧杯中, 测出盐酸温度;
②用另一量筒量取 50mL 0.55mol·L-1 NaOH 溶液, 并用同一温度计测出其温度;
③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。 回答下列问题:
(2)为什么所用 NaOH 溶液要稍过量?_______
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1,为了计算中和热,某学生实验记录数据如表:
依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ kJ·mol-1(结果保留一位小数)。
(4)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______ 。
途径 I:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ∆H=-a kJ·mol-1
途径 II:C3H8(g)=C3H6(g)+H2(g) ∆H=+b kJ·mol-1
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ∆H=-d kJ·mol-1(a、b、c、d 均为正值)
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量
II.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50mL 0.50mol·L-1盐酸倒入小烧杯中, 测出盐酸温度;
②用另一量筒量取 50mL 0.55mol·L-1 NaOH 溶液, 并用同一温度计测出其温度;
③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。 回答下列问题:
(2)为什么所用 NaOH 溶液要稍过量?
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1,为了计算中和热,某学生实验记录数据如表:
实验 序号 | 起始温度 t1/℃ | 终止温度 t2/℃ | |
| 盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.1 |
2 | 20.1 | 20.1 | 23.3 |
3 | 20.1 | 20.1 | 24.5 |
4 | 20.2 | 20.2 | 23.5 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
(4)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是
您最近一年使用:0次
2021-10-21更新
|
91次组卷
|
2卷引用:江西省临川第十中学2021-2022学年高二上学期第一次月考化学试题
6 . I.实验室利用如图装置进行中和热的测定,请回答下列问题:
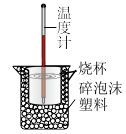
(1)该图中缺少的仪器或用品有__ 。
(2)①如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”绝对值将___ (填“偏大”“偏小”或“不变")
②如用0.5mol/L的CH3COOH与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将___ (填“偏大”“偏小”或“不变")
③如用18.4mol/L的H2SO4与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将___ 。(填“偏大”“偏小”或“不变")
II.CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图所示:

(3)该过程用化学反应方程式表示为___ ,反应的△H___ 0(填“<”>”或“=”)。
(4)从起始到过渡态断裂的化学键有___ ,该过程___ (填“放出”或“吸收”)能量。

(1)该图中缺少的仪器或用品有
(2)①如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”绝对值将
②如用0.5mol/L的CH3COOH与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将
③如用18.4mol/L的H2SO4与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将
II.CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图所示:

(3)该过程用化学反应方程式表示为
(4)从起始到过渡态断裂的化学键有
您最近一年使用:0次
7 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
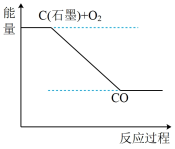 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次
名校
解题方法
8 . (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:
①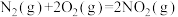 ,
,
② ,
,
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:______
(2)等质量的下列物质分别完全燃烧,放出热量较多的是反应过程________ (填选项字母)。
A.固体硫 B.硫蒸气
(3)已知:通常条件下,强酸、强碱稀溶液中和生成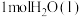 放出的热量为中和热。稀溶液中
放出的热量为中和热。稀溶液中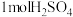 和足量NaOH恰好反应时放出QkJ热量,则其中和热为
和足量NaOH恰好反应时放出QkJ热量,则其中和热为________  。
。
(4) 已知 和
和 反应放热,且断开
反应放热,且断开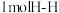 键、
键、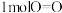 键、
键、 键吸收的能量分别为
键吸收的能量分别为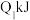 、
、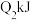 、
、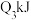 ,由此推知下列关系正确的是
,由此推知下列关系正确的是________ (填选项字母)。
A.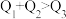 B.
B.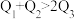 C.
C.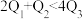 D.
D.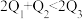
①
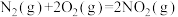 ,
,
②
 ,
,
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:
(2)等质量的下列物质分别完全燃烧,放出热量较多的是反应过程
A.固体硫 B.硫蒸气
(3)已知:通常条件下,强酸、强碱稀溶液中和生成
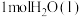 放出的热量为中和热。稀溶液中
放出的热量为中和热。稀溶液中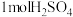 和足量NaOH恰好反应时放出QkJ热量,则其中和热为
和足量NaOH恰好反应时放出QkJ热量,则其中和热为 。
。(4) 已知
 和
和 反应放热,且断开
反应放热,且断开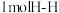 键、
键、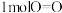 键、
键、 键吸收的能量分别为
键吸收的能量分别为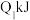 、
、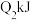 、
、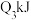 ,由此推知下列关系正确的是
,由此推知下列关系正确的是A.
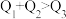 B.
B.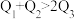 C.
C.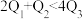 D.
D.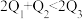
您最近一年使用:0次
9 . 盖斯定律:内容:1840年,瑞典化学家盖斯通过大量实验证明:不管化学反应是_______ 完成或__________ 完成,其反应热是_______ 的。也就是说,化学反应的反应热只与反应体系的_____ 和______ 有关而与反应的途径无关。
您最近一年使用:0次
9-10高一下·浙江金华·期末
10 . 现有两个氢气燃烧生成水的热化学方程式:


请回答下列问题:
(1)若 完全燃烧生成水蒸气,则放出的热量
完全燃烧生成水蒸气,则放出的热量______ (填“>”“<”或“=”) 。
。
(2)反应热的关系:
____ (填“>”“<”或“=”)b。
(3)已知 ,且氧气中
,且氧气中 化学键完全断裂时吸收热量
化学键完全断裂时吸收热量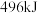 ,水蒸气中
,水蒸气中 键形成时放出热量
键形成时放出热量 ,则氢气中
,则氢气中 键断裂时吸收的热量为
键断裂时吸收的热量为_______ 。


请回答下列问题:
(1)若
 完全燃烧生成水蒸气,则放出的热量
完全燃烧生成水蒸气,则放出的热量 。
。(2)反应热的关系:

(3)已知
 ,且氧气中
,且氧气中 化学键完全断裂时吸收热量
化学键完全断裂时吸收热量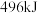 ,水蒸气中
,水蒸气中 键形成时放出热量
键形成时放出热量 ,则氢气中
,则氢气中 键断裂时吸收的热量为
键断裂时吸收的热量为
您最近一年使用:0次
2020-09-17更新
|
250次组卷
|
4卷引用:09-10年金华市普通高中高一下学期期末考试化学卷
(已下线)09-10年金华市普通高中高一下学期期末考试化学卷人教版高二化学选修四专题:化学反应与能量变化同步练习题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第一节 反应热2



