名校
解题方法
1 . 洁厕灵是一种清洁用品,其主要成分是盐酸,还有微量的表面活性剂、香精和其他助剂。我校郝老师带领班上化学兴趣小组,用标准 溶液滴定市售的一品牌洁厕灵中盐酸的物质的量浓度(该洁厕灵中,能与
溶液滴定市售的一品牌洁厕灵中盐酸的物质的量浓度(该洁厕灵中,能与 溶液反应的只有盐酸)。回答下列问题:
溶液反应的只有盐酸)。回答下列问题:
(1)欲配制 标准
标准 溶液所需的仪器有:托盘天平、量筒、
溶液所需的仪器有:托盘天平、量筒、___________ 、___________ 、烧杯、胶头滴管和药匙等(填玻璃仪器)。
(2)取用洁厕灵用___________ (“碱式滴定管”、“酸式滴定管”)取用20.00mL,使用该仪器时,先要检漏,洗涤,在装液前必须进行___________ 操作后,再装液排气泡,最后装液至0.00mL处或略下。
(3)若该滴定实验用酚酞作指示剂,则达到滴定终点时的现象是___________ 。
(4)若出现下列情况,会导致结果偏小的是___________ (填序号)
①不小心将标准溶液滴至锥形瓶外
②刚变色后立即记下数据
③滴定前滴定管中有气泡,滴定后气泡消失
④用含有 杂质的氢氧化钠固体配制标准溶液
杂质的氢氧化钠固体配制标准溶液
(5)若用 的标准
的标准 溶液滴定稀释10倍的洁厕灵为待测液,并重复三次,操作步骤合理,实验数据如表所示:
溶液滴定稀释10倍的洁厕灵为待测液,并重复三次,操作步骤合理,实验数据如表所示:
通过计算可知该市售洁厕灵中盐酸的物质的量浓度为___________ 。
 溶液滴定市售的一品牌洁厕灵中盐酸的物质的量浓度(该洁厕灵中,能与
溶液滴定市售的一品牌洁厕灵中盐酸的物质的量浓度(该洁厕灵中,能与 溶液反应的只有盐酸)。回答下列问题:
溶液反应的只有盐酸)。回答下列问题:(1)欲配制
 标准
标准 溶液所需的仪器有:托盘天平、量筒、
溶液所需的仪器有:托盘天平、量筒、(2)取用洁厕灵用
(3)若该滴定实验用酚酞作指示剂,则达到滴定终点时的现象是
(4)若出现下列情况,会导致结果偏小的是
①不小心将标准溶液滴至锥形瓶外
②刚变色后立即记下数据
③滴定前滴定管中有气泡,滴定后气泡消失
④用含有
 杂质的氢氧化钠固体配制标准溶液
杂质的氢氧化钠固体配制标准溶液(5)若用
 的标准
的标准 溶液滴定稀释10倍的洁厕灵为待测液,并重复三次,操作步骤合理,实验数据如表所示:
溶液滴定稀释10倍的洁厕灵为待测液,并重复三次,操作步骤合理,实验数据如表所示:| 滴定次数 | 待测液的体积/ | 滴定前滴定管刻度/ | 滴定后滴定管刻度/ |
| 1 | 20.00 | 5.00 | 27.10 |
| 2 | 20.00 | 4.50 | 26.50 |
| 3 | 20.00 | 5.20 | 27.10 |
您最近一年使用:0次
解题方法
2 . 滴定是一种定量分析的手段,也是一种化学实验操作,常用到如图两种滴定管。

(1)量取 溶液时,应选用
溶液时,应选用______ (填“A”或“B”)。
(2)滴定管使用前需要进行的操作为__________ 。
(3)某 酸式滴定管中液面高度如图所示,则该滴定管中所盛装液体的总体积为________(填选项字母)。
酸式滴定管中液面高度如图所示,则该滴定管中所盛装液体的总体积为________(填选项字母)。

(4)用浓度为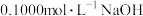 标准溶液滴定
标准溶液滴定 未知浓度醋酸溶液。
未知浓度醋酸溶液。
①该滴定实验应选用__________ 填“酚酞”“石蕊”或“甲基橙”)作指示剂,滴定至终点的实验现象为__________ 。
②滴定过程中眼睛应始终注视__________ (填字母)。
a.锥形瓶内液体颜色变化
b.滴定管内液面变化
c.滴加液体速度
③平行滴定了三次,所得数据如下表。
醋酸溶液的浓度为__________  。
。
④若未用 标准溶液润洗滴定管,则最终测得醋酸浓度会
标准溶液润洗滴定管,则最终测得醋酸浓度会__________ (填“偏大”“偏小”或“无影响”)。
(5)某同学在使用完滴定管后用蒸馏水洗净,并烘干。该同学的操作__________ (填“合理”或“不合理”),原因为__________ 。

(1)量取
 溶液时,应选用
溶液时,应选用(2)滴定管使用前需要进行的操作为
(3)某
 酸式滴定管中液面高度如图所示,则该滴定管中所盛装液体的总体积为________(填选项字母)。
酸式滴定管中液面高度如图所示,则该滴定管中所盛装液体的总体积为________(填选项字母)。
A. | B. | C.大于 | D.小于 |
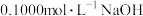 标准溶液滴定
标准溶液滴定 未知浓度醋酸溶液。
未知浓度醋酸溶液。①该滴定实验应选用
②滴定过程中眼睛应始终注视
a.锥形瓶内液体颜色变化
b.滴定管内液面变化
c.滴加液体速度
③平行滴定了三次,所得数据如下表。
实验次数 | 1 | 2 | 3 |
消耗 | 15.04 | 18.00 | 14.96 |
 。
。④若未用
 标准溶液润洗滴定管,则最终测得醋酸浓度会
标准溶液润洗滴定管,则最终测得醋酸浓度会(5)某同学在使用完滴定管后用蒸馏水洗净,并烘干。该同学的操作
您最近一年使用:0次
名校
解题方法
3 . 某同学利用如下实验仪器及试剂完成酸碱中和反应反应热的测定实验。
仪器如下:
试剂:pH=1的盐酸、pH=1的醋酸、NaOH固体、酚酞、石蕊、蒸馏水。
回答下列有关问题:
(1)由于两瓶酸的标签已脱落,请利用上述仪器和试剂设计实验来确认哪一瓶是盐酸,实验方案:___________ 。
(2)①配制250mLNaOH溶液:由于缺少___________ (填仪器名称),无法准确配制0.1000mol·L-1的NaOH溶液。
②用中和滴定法测定新配制的NaOH溶液的物质的量浓度,其操作可分解为如下几步:
a.检查滴定管是否漏水;
b.取20.00mL的待测液于锥形瓶中,并滴加几滴指示剂;
c.用标准溶液润洗装标准溶液的滴定管,用待测液润洗装待测液的滴定管;
d.装标准溶液和待测液并调整液面(记录初读数);
e.用蒸馏水洗涤玻璃仪器;
f.进行滴定操作。
正确的操作顺序为___________ 。(填字母序号)
③选用0.1000mol·L-1的盐酸为标准溶液、___________ 作指示剂;滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视___________ ;直到___________ 为止。滴定结果如下所示:
则新配制的NaOH溶液的物质的量浓度为___________ mol·L-1.
(3)完成酸碱中和反应反应热的测定实验(溶液的密度均视为1g·mL-1,反应后生成溶液的比热容c=4.2J·g-1·°C-1):取碎纸条、硬纸板以及D、E、H组装好实验装置,实验中取50mLpH=1的盐酸与50mL新配制的NaOH溶液进行反应,若测得反应前后温差为0.67°C,经计算该实验中酸碱中和生成1mol水时放出的热量为56.28kJ,该数值与理论值(理论值为57.3kJ)有偏差,其原因可能是___________ (填字母序号)。
A.采用铜制搅拌棒
B.量筒量取NaOH溶液时仰视读数
C.分多次将NaOH溶液倒入装有盐酸的小烧杯中
D.测完HCl溶液的温度后,用水把温度计上的酸冲洗干净,擦干后,过一段时间再测量NaOH溶液的温度
仪器如下:

试剂:pH=1的盐酸、pH=1的醋酸、NaOH固体、酚酞、石蕊、蒸馏水。
回答下列有关问题:
(1)由于两瓶酸的标签已脱落,请利用上述仪器和试剂设计实验来确认哪一瓶是盐酸,实验方案:
(2)①配制250mLNaOH溶液:由于缺少
②用中和滴定法测定新配制的NaOH溶液的物质的量浓度,其操作可分解为如下几步:
a.检查滴定管是否漏水;
b.取20.00mL的待测液于锥形瓶中,并滴加几滴指示剂;
c.用标准溶液润洗装标准溶液的滴定管,用待测液润洗装待测液的滴定管;
d.装标准溶液和待测液并调整液面(记录初读数);
e.用蒸馏水洗涤玻璃仪器;
f.进行滴定操作。
正确的操作顺序为
③选用0.1000mol·L-1的盐酸为标准溶液、
| 次数 | 盐酸溶液起始读数 | 盐酸溶液终点读数 |
| 第一次 | 0.10mL | 23.75mL |
| 第二次 | 0.80mL | 24.40mL |
| 第三次 | 0.30mL | 23.85mL |
(3)完成酸碱中和反应反应热的测定实验(溶液的密度均视为1g·mL-1,反应后生成溶液的比热容c=4.2J·g-1·°C-1):取碎纸条、硬纸板以及D、E、H组装好实验装置,实验中取50mLpH=1的盐酸与50mL新配制的NaOH溶液进行反应,若测得反应前后温差为0.67°C,经计算该实验中酸碱中和生成1mol水时放出的热量为56.28kJ,该数值与理论值(理论值为57.3kJ)有偏差,其原因可能是
A.采用铜制搅拌棒
B.量筒量取NaOH溶液时仰视读数
C.分多次将NaOH溶液倒入装有盐酸的小烧杯中
D.测完HCl溶液的温度后,用水把温度计上的酸冲洗干净,擦干后,过一段时间再测量NaOH溶液的温度
您最近一年使用:0次
名校
解题方法
4 . 某学生用0.1000mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.调节液面至“0”或“0”以下某一刻度,记下读数
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.用标准溶液润洗滴定管2~3次
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)A→___________ →F;
(2)若无上述E步骤操作,则测定结果会_______ (填“偏高”、“偏低”或“无影响”,下同);
(3)上述A步骤之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是_______ 。
(4)判断到达滴定终点的现象是________ 。
(5)若甲学生在实验过程中,记录滴定前滴定管内液面读数为2.60ml,滴定后液面如图,则此时消耗标准溶液的体积为______ mL。

(6)乙学生做了三组平行实验,数据记录如下:选取下述合理数据,计算出待测溶液的物质的量浓度为________ ; 保留四位有效数字
保留四位有效数字
A.移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.调节液面至“0”或“0”以下某一刻度,记下读数
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.用标准溶液润洗滴定管2~3次
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)A→
(2)若无上述E步骤操作,则测定结果会
(3)上述A步骤之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是
(4)判断到达滴定终点的现象是
(5)若甲学生在实验过程中,记录滴定前滴定管内液面读数为2.60ml,滴定后液面如图,则此时消耗标准溶液的体积为

(6)乙学生做了三组平行实验,数据记录如下:选取下述合理数据,计算出待测溶液的物质的量浓度为
 保留四位有效数字
保留四位有效数字
| 实验序号 | 待测HCl溶液的体积 | 0.1000mol·L-1的KOH溶液的体积 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 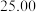 |  | 25.33 |
| 2 | 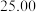 | 0.00 | 30.00 |
| 3 | 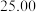 |  | 25.67 |
您最近一年使用:0次
解题方法
5 . 氯碱厂质检人员用滴定法测定某NaOH溶液的浓度。
(1)洗涤滴定管前必须首先________ 。
(2)选用盐酸作为标准溶液进行测定实验。将盐酸装入______ ,NaOH溶液装入______ ,滴加______ 作指示剂。滴定时,眼睛注视________ ,当锥形瓶内______ 即达滴定终点。记录此时滴定管内液面读数V(末)。
(3)实验数据记录及处理:标准盐酸浓度:0.1054mol/L
若NaOH溶液的准确浓度为 0.1005mol/L,实验误差是_______ %。
(4)若测定结果偏低,原因可能是________。
(1)洗涤滴定管前必须首先
(2)选用盐酸作为标准溶液进行测定实验。将盐酸装入
(3)实验数据记录及处理:标准盐酸浓度:0.1054mol/L
| 实验次数 | 待测氢氧化钠溶液体积(mL) | 标准盐酸体积(mL) | NaOH溶液浓度(mol/L) | ||
| 初读数 | 末读数 | 体积 | |||
| 1 | 20.00 | 0.50 | 20.70 | | |
| 2 | 20.00 | 6.00 | 26.00 | | |
(4)若测定结果偏低,原因可能是________。
| A.见到指示剂的颜色有变化就停止滴定 |
| B.锥形瓶用蒸馏水清洗后,未用待装液润洗 |
| C.读数时,若滴定前视线偏低,滴定后视线偏高 |
| D.滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡 |
您最近一年使用:0次
名校
解题方法
6 . 如图是用 的盐酸滴定某未知浓度的NaOH溶液的示意图。
的盐酸滴定某未知浓度的NaOH溶液的示意图。

请回答下列问题:
(1)仪器A的名称是___________ 。
(2)某学生的操作步骤如下:
A.移取20.00mL待测NaOH溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管使尖嘴部分充满溶液;调节液面至“0”或“0”以下刻度,记下读数;
D.取标准盐酸溶液注入酸式滴定管至“0”刻度以上23mL;
E.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是___________ (用字母序号填写)。上述B步骤操作的目的是___________ 。判断到达滴定终点的实验现象是___________ 。
(3)如图为某次滴定前、后盛放盐酸的滴定管中液面的位置。
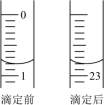
盐酸的体积读数:滴定前读数为___________ mL,滴定后读数为___________ mL。
(4)某实验小组同学的三次实验的实验数据如下表所示,根据表中数据计算出的待测NaOH溶液的平均浓度是___________  。
。
(5)对下列几种假定情况进行讨论:
①盛标准溶液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,对测定结果的影响是___________ (填“偏高”“偏低”或“无影响”,下同);
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________ ;
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是___________ 。
 的盐酸滴定某未知浓度的NaOH溶液的示意图。
的盐酸滴定某未知浓度的NaOH溶液的示意图。
请回答下列问题:
(1)仪器A的名称是
(2)某学生的操作步骤如下:
A.移取20.00mL待测NaOH溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管使尖嘴部分充满溶液;调节液面至“0”或“0”以下刻度,记下读数;
D.取标准盐酸溶液注入酸式滴定管至“0”刻度以上23mL;
E.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是
(3)如图为某次滴定前、后盛放盐酸的滴定管中液面的位置。

盐酸的体积读数:滴定前读数为
(4)某实验小组同学的三次实验的实验数据如下表所示,根据表中数据计算出的待测NaOH溶液的平均浓度是
 。
。| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
①盛标准溶液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,对测定结果的影响是
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是
您最近一年使用:0次
名校
解题方法
7 . 如图是用0.1000mol⋅L−1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前后盛放盐酸的滴定管中液面的位置。
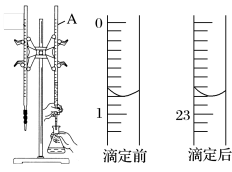
请回答下列问题:
(1)仪器A的名称是___________ 。
(2)盐酸的体积读数:滴定前读数为___________ mL,滴定后读数___________ mL
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出待测NaOH溶液的平均浓度是___________ mol⋅L−1(保留四位有效数字)
(4)对下列几种假定情况进行讨论(填“无影响”“偏高”或“偏低”):
①量取待测液的滴定管,放出溶液前滴定管尖端有气泡,放出溶液后气泡消失,对测定结果的影响是___________ ;
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________ ;
③用湿润的pH试纸测稀硫酸溶液的pH,对测定结果的影响是___________ 。

请回答下列问题:
(1)仪器A的名称是
(2)盐酸的体积读数:滴定前读数为
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出待测NaOH溶液的平均浓度是
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(4)对下列几种假定情况进行讨论(填“无影响”“偏高”或“偏低”):
①量取待测液的滴定管,放出溶液前滴定管尖端有气泡,放出溶液后气泡消失,对测定结果的影响是
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
③用湿润的pH试纸测稀硫酸溶液的pH,对测定结果的影响是
您最近一年使用:0次
名校
解题方法
8 . 已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:
①称量1.00g样品溶于水配成250mL溶液:
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2—3滴指示剂:
③用 的标准盐酸滴定并重复三次,每次实验数据记录如下:
的标准盐酸滴定并重复三次,每次实验数据记录如下:
请回答下列问题:
(1)实验步骤②中所滴加的指示剂是___________ 。
(2)排除碱式滴定管胶管中气泡的方法是__________ (填字母)。

(3)在该实验的滴定过程中用左手控制_______ 。(填仪器及部位),眼睛________ ,直至滴定终点。
(4)判断达到滴定终点时的现象为_____________________________________________ 。
(5)若出现下列情况,导致测定结果偏高的是___________ (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(6)通过计算可知该烧碱样品的纯度为___________ 。
①称量1.00g样品溶于水配成250mL溶液:
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2—3滴指示剂:
③用
 的标准盐酸滴定并重复三次,每次实验数据记录如下:
的标准盐酸滴定并重复三次,每次实验数据记录如下:滴定序号 | 待测液体积/mL | 消耗盐酸的体积/mL | |
滴定前 | 滴定后 | ||
1 2 3 | 25.00 25.00 25.00 | 0.50 6.00 1.10 | 20.60 26.00 21.00 |
(1)实验步骤②中所滴加的指示剂是
(2)排除碱式滴定管胶管中气泡的方法是

(3)在该实验的滴定过程中用左手控制
(4)判断达到滴定终点时的现象为
(5)若出现下列情况,导致测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(6)通过计算可知该烧碱样品的纯度为
您最近一年使用:0次
名校
解题方法
9 . 某学生用 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酸碱指示剂;
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___________ ,该错误操作会导致测定结果___________ (填“偏大”、“偏小”或“无影响”)。
(2)下列操作会引起实验结果偏大的是______。
(3)最合适的酸碱指示剂为___________ ,它的变色范围是___________ 。判断达到滴定终点的现象是___________ 。
(4)以下是实验数据记录表。
通过计算可得,该盐酸浓度为:___________ mol/L。
 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酸碱指示剂;
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上操作步骤中有一步有错误,请指出编号
(2)下列操作会引起实验结果偏大的是______。
| A.在锥形瓶装液前,留有少量蒸馏水 |
| B.滴定前,装标准碱液的滴定管尖嘴有气泡,滴定后无气泡 |
| C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗 |
| D.用滴定管量取待测液时将一滴待测液滴在锥形瓶外 |
(4)以下是实验数据记录表。
| 滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.25 |
| 2 | 20.00 | 0.10 | 18.45 |
| 3 | 20.00 | 0.30 | 19.75 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中反应的化学方程式为________ 。
(2)除去C中过量的H2O2,然后用0.0900mol•L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_______ (填序号);简述排气泡的操作:_______ 。
(3)①若滴定终点时溶液的pH=8.8,则选择的指示剂为________ ;描述达到滴定终点的现象:_______ 。
②若滴定终点时溶液的pH=4.2,则选择的指示剂为__________ ;描述达到滴定终点的现象:_______ 。
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________ (填序号)。
①=10mL ②=40mL ③<10mL ④>40mL
(5)滴定至终点时,消耗NaOH溶液25.00mL,列式计算该葡萄酒中SO2含量:________ 。
(6)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:_______ 。

(1)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中反应的化学方程式为
(2)除去C中过量的H2O2,然后用0.0900mol•L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的
(3)①若滴定终点时溶液的pH=8.8,则选择的指示剂为
②若滴定终点时溶液的pH=4.2,则选择的指示剂为
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积
①=10mL ②=40mL ③<10mL ④>40mL
(5)滴定至终点时,消耗NaOH溶液25.00mL,列式计算该葡萄酒中SO2含量:
(6)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
您最近一年使用:0次



