名校
1 . 钠及其化合物在生产、生活中有着重要的用途,根据所学知识,回答下列问题。
Ⅰ.某汽车安全气囊的产气药剂主要含有 等物质。 当汽车发生碰撞时,NaN3迅速分解产生N2和 Na,同时放出大量的热,
等物质。 当汽车发生碰撞时,NaN3迅速分解产生N2和 Na,同时放出大量的热, 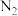 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
(1)KClO4 可处理产生的Na,KClO4中氯元素的化合价为_______ 。
(2) 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为_______ 。
Ⅱ.某实验小组设计如下实验方案测定 与
与 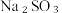 混合物中各组分的含量。
混合物中各组分的含量。
(3)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g,计算。
①实验中加热至恒重的目的是_______ 。
②样品中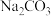 的质量分数为
的质量分数为_______ 。
(4)方案二:用如图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验。

①装置C的作用是_______ ;装置F的作用是_______
②实验过程中,当装置A内的固体反应完全后,需打开活塞K,向 A 中通入大量的氮气。这样做的目的是_______ 。
(5)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量。 溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是_______ 。
Ⅰ.某汽车安全气囊的产气药剂主要含有
 等物质。 当汽车发生碰撞时,NaN3迅速分解产生N2和 Na,同时放出大量的热,
等物质。 当汽车发生碰撞时,NaN3迅速分解产生N2和 Na,同时放出大量的热, 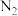 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。(1)KClO4 可处理产生的Na,KClO4中氯元素的化合价为
(2)
 是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式为Ⅱ.某实验小组设计如下实验方案测定
 与
与 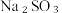 混合物中各组分的含量。
混合物中各组分的含量。(3)方案一:称取30g样品,置于坩埚中加热至恒重,冷却、称量,剩余固体质量为31.6g,计算。
①实验中加热至恒重的目的是
②样品中
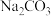 的质量分数为
的质量分数为(4)方案二:用如图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验。

①装置C的作用是
②实验过程中,当装置A内的固体反应完全后,需打开活塞K,向 A 中通入大量的氮气。这样做的目的是
(5)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量。
 溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗涤干净的方法是
您最近半年使用:0次
2023-10-31更新
|
134次组卷
|
3卷引用:贵州省部分名校2023-2024学年高三上学期10月大联考化学试题
2 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制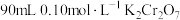 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还有________ 。
②计算,称量:需用托盘天平称量________ g  固体[
固体[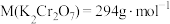 ]。
]。
③溶解,恢复到室温、转移、洗涤、定容。
④下列操作使结果偏高 的是________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线
D.未用蒸馏水洗涤烧杯和玻璃棒
E.溶液未恢复至室温即转移
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以 和
和 的形式存在)
的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ (用离子方程式)。
②请配平步骤②中发生反应的离子反应方程式:_______________
____ ______
______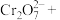 ______
______ _____
_____ _____
_____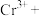 _____
_____ 。
。
③某同学3次测定所消耗的 溶液的体积如下:
溶液的体积如下:
消耗 溶液的平均体积是
溶液的平均体积是___________ mL。
④实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
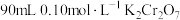 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还有
②计算,称量:需用托盘天平称量
 固体[
固体[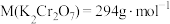 ]。
]。③溶解,恢复到室温、转移、洗涤、定容。
④下列操作使结果
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线
D.未用蒸馏水洗涤烧杯和玻璃棒
E.溶液未恢复至室温即转移
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以
 和
和 的形式存在)
的形式存在)| 步骤一 | 取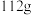 黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入 酸性 酸性 溶液,恰好完全反应 溶液,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
____
 ______
______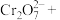 ______
______ _____
_____ _____
_____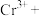 _____
_____ 。
。③某同学3次测定所消耗的
 溶液的体积如下:
溶液的体积如下:| 测定次数 | 第1次 | 第2次 | 第3次 |
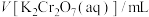 | 10.00 | 9.98 | 10.02 |
 溶液的平均体积是
溶液的平均体积是④实验测得黑木耳中铁元素的质量分数为
您最近半年使用:0次
3 . 氧钒(IV)碱式碳酸铵晶体难溶于水,是制备热敏材料 的原料,其化学式为
的原料,其化学式为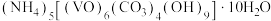 。实验室以
。实验室以 和
和 为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知
为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知 价钒的化合物易被氧化。回答下列问题:
价钒的化合物易被氧化。回答下列问题:
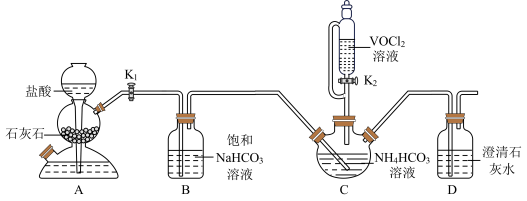
(1)盛装 溶液的仪器的名称为
溶液的仪器的名称为___________ 。
(2)实验步骤I:检查装置气密性,开始实验,先___________ (填实验操作),当D中溶液变浑浊,关闭 ,进行上述实验操作的目的是
,进行上述实验操作的目的是___________ 。
实验步骤II:打开 ,滴入
,滴入 溶液,开始反应。
溶液,开始反应。
(3)装置B中饱和 溶液的作用是
溶液的作用是___________ 。
(4) 溶液可由
溶液可由 经过还原制备,该还原过程需要加入稀盐酸和
经过还原制备,该还原过程需要加入稀盐酸和 ,且其他产物均为绿色环保物质,写出该反应的化学方程式:
,且其他产物均为绿色环保物质,写出该反应的化学方程式:___________ 。
(5)测定粗产品[氧钒(IV)碱式碳酸铵晶体]中钒的含量。实验步骤如下:称量m g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用 标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知:
标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知: )
)
① 溶液的作用是
溶液的作用是___________ 。
②粗产品中钒的质量分数表达式为___________ (以 计)。
计)。
③若滴定前俯视读数,终点时仰视读数,则测定结果___________ (填“偏高”“偏低”或“无影响”)。
 的原料,其化学式为
的原料,其化学式为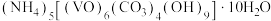 。实验室以
。实验室以 和
和 为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知
为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知 价钒的化合物易被氧化。回答下列问题:
价钒的化合物易被氧化。回答下列问题:
(1)盛装
 溶液的仪器的名称为
溶液的仪器的名称为(2)实验步骤I:检查装置气密性,开始实验,先
 ,进行上述实验操作的目的是
,进行上述实验操作的目的是实验步骤II:打开
 ,滴入
,滴入 溶液,开始反应。
溶液,开始反应。(3)装置B中饱和
 溶液的作用是
溶液的作用是(4)
 溶液可由
溶液可由 经过还原制备,该还原过程需要加入稀盐酸和
经过还原制备,该还原过程需要加入稀盐酸和 ,且其他产物均为绿色环保物质,写出该反应的化学方程式:
,且其他产物均为绿色环保物质,写出该反应的化学方程式:(5)测定粗产品[氧钒(IV)碱式碳酸铵晶体]中钒的含量。实验步骤如下:称量m g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入
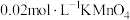 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用 标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知:
标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知: )
)①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数表达式为
 计)。
计)。③若滴定前俯视读数,终点时仰视读数,则测定结果
您最近半年使用:0次
解题方法
4 . 利用冶炼、电池生产等工业中产生的废锌浮渣(主要含Zn和ZnO,还含有少量FeO、MnO、CuO、CdO等氧化物或硫酸盐及少量SiO2等)。采用如下工艺流程回收其中的锌制备氯化锌:
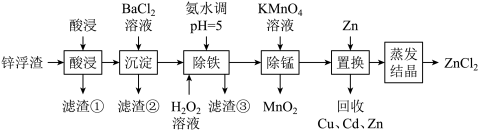
回答下列问题:
(1)“酸浸”中盐酸与ZnO反应的化学方程式_______ 。
(2)“沉淀”除去的离子是_______ 。
(3)“除铁”时先后加入了两种试剂,应先加入_______ ,再加入_______ ,原因是_______ 。
(4)“除锰”时的离子方程式为_______ 。
(5)制得的ZnCl2成品中可能含有的杂质为Zn(OH)Cl,已知浓缩液的蒸发温度与碱式盐的含量如图所示。
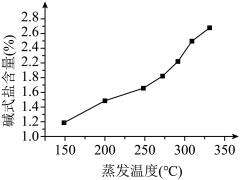
①降低成品中的碱式盐含量的方法有_______ 。
②采用中和滴定法测定该样品的组成,实验步骤如下:取10.0000g样品于锥形瓶中,加入50ml.蒸馏水溶解,用甲基橙做指示剂,用0.1000 mol/L的盐酸滴定至溶液由黄色变为浅红色且30s内不恢复成原色,消耗盐酸的体积为20.00mL。样品中所含Zn(OH)Cl(M=117.5g/mol)杂质的质量分数为_______ 。

回答下列问题:
(1)“酸浸”中盐酸与ZnO反应的化学方程式
(2)“沉淀”除去的离子是
(3)“除铁”时先后加入了两种试剂,应先加入
(4)“除锰”时的离子方程式为
(5)制得的ZnCl2成品中可能含有的杂质为Zn(OH)Cl,已知浓缩液的蒸发温度与碱式盐的含量如图所示。

①降低成品中的碱式盐含量的方法有
②采用中和滴定法测定该样品的组成,实验步骤如下:取10.0000g样品于锥形瓶中,加入50ml.蒸馏水溶解,用甲基橙做指示剂,用0.1000 mol/L的盐酸滴定至溶液由黄色变为浅红色且30s内不恢复成原色,消耗盐酸的体积为20.00mL。样品中所含Zn(OH)Cl(M=117.5g/mol)杂质的质量分数为
您最近半年使用:0次
2021-01-14更新
|
860次组卷
|
4卷引用:贵州省贵阳市五校2021-2022学年高三年级上学期联合考试(三)理科综合化学试题
贵州省贵阳市五校2021-2022学年高三年级上学期联合考试(三)理科综合化学试题四川省资阳、眉山、遂宁、广安、自贡、广元等六市2021届第一次诊断性考试理综化学试题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)学科网2020年高三1月大联考考后强化卷(山东卷)
解题方法
5 . 过滤在实验、生产、生活中有着广泛的应用。某研究性学习小组在实验室测定某含NaCl杂质的碳酸钠样品中Cl-的含量,其实验步骤如下:
①将100g样品溶于水得到溶液A;
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来;
③经过滤,得到固体C,洗涤,干燥;
④称量得固体C的质量
(1)沉淀剂B为___________ (填化学式)。
(2)向A中加入稀HNO3酸化的目的是___________ 。
(3)如何洗涤固体C:___________ 。
(4)如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数___________ (填“偏大”“偏小”或“不变”)。
①将100g样品溶于水得到溶液A;
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来;
③经过滤,得到固体C,洗涤,干燥;
④称量得固体C的质量
(1)沉淀剂B为
(2)向A中加入稀HNO3酸化的目的是
(3)如何洗涤固体C:
(4)如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数
您最近半年使用:0次
名校
解题方法
6 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
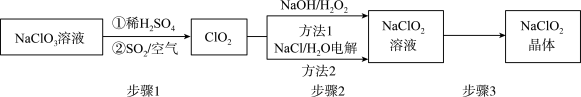
已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
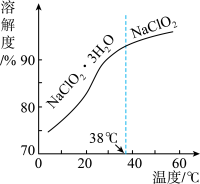
2.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___ ,通入空气的作用是____ 。
(2)方法1中,反应的离子方程式是___ ,利用方法1制NaClO2时,温度不能超过20℃,可能的原因是____ 。
(3)方法2中,NaClO2在___ 生成(选填“阴极”或“阳极”)。
(4)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是__ 。
(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为____ 。(用含a、b、c的代数式表示)。

已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是
(2)方法1中,反应的离子方程式是
(3)方法2中,NaClO2在
(4)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是

(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为
您最近半年使用:0次
名校
7 . 某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___ 离子,滤渣中含有___ ;在溶解过滤时使用的仪器有___ 。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____ 。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____ 。
(5)计算该样品中铝的质量分数的表达式为___ 。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___ (“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___ 。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____ 。
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为
(5)计算该样品中铝的质量分数的表达式为
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果
您最近半年使用:0次
2020-01-07更新
|
162次组卷
|
5卷引用:贵州省黎平第二中学2019-2020学年高一上学期期末考试化学试题
解题方法
8 . 现有一份含Fe2O3、Al2O3、SiO2的混合物,为测定其中铁元素的含量,进行如下实验:
①称取混合物A g,滴加过量盐酸充分反应后过滤;
②在滤液中滴加过量氢氧化钠溶液充分反应后过滤;
③洗涤②所得沉淀,烘干后称重,质量为B g。
回答下列问题:
(1)步骤①中过滤所用的玻璃仪器有__________________________ ;
(2)步骤①所得滤液中铁元素的存在形式是_______ (填离子符号),怎样检验它的存在(写出实验操作和现象)___________________________ ;
(3)步骤②中涉及的离子方程式是_________________ 、________________ 、_______________ ;
(4)该混合物中铁元素的质量分数为_______________ (用含A、B的式子表示)。
①称取混合物A g,滴加过量盐酸充分反应后过滤;
②在滤液中滴加过量氢氧化钠溶液充分反应后过滤;
③洗涤②所得沉淀,烘干后称重,质量为B g。
回答下列问题:
(1)步骤①中过滤所用的玻璃仪器有
(2)步骤①所得滤液中铁元素的存在形式是
(3)步骤②中涉及的离子方程式是
(4)该混合物中铁元素的质量分数为
您最近半年使用:0次
9 . A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)A在元素周期表中的位置是_________ ;A与E形成的化合物的电子式是_________ 。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是________ 。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是___________ 。
(4)F的盐酸盐水溶液呈酸性,原因是________ (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是__________ 。
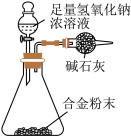
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和上图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。a是__________ ;b是__________ 。
②合金中A元素的质量分数是________ (用含m、a、b的式子表示)。
| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)A在元素周期表中的位置是
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
(4)F的盐酸盐水溶液呈酸性,原因是

(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和上图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。a是
②合金中A元素的质量分数是
您最近半年使用:0次
名校
解题方法
10 . 某化学实验室需要0.2mol·L−1硫酸溶液480mL,根据溶液的配制情况回答下列问题:
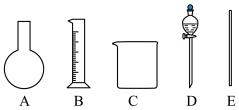
(1)如图所示的仪器中配制溶液需要用到的是___________ (填序号),配制上述溶液还需用到的玻璃仪器是胶头滴管、___________ (填仪器名称)。
(2)现用质量分数为98%、密度为1.84g·L−1的浓硫酸来配制480mL、0.2mol·L−1的稀硫酸,计算该浓硫酸的物质的量浓度为___________ mol·L−1,需要该浓硫酸的体积为___________ mL(保留1位小数),现有①10mL②25mL③30mL④100mL四种规格的量筒,你选用的量筒是___________ (填代号)。
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为:②→①→③→⑧→_______ →_______ →_______ →④(填序号)。
(4)在配制过程中,下列操作正确的是___________ (填代号,下同),其他操作都准确,能引起误差偏低的有___________ 。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②等稀释后的H2SO4溶液冷却至室温再转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线

(1)如图所示的仪器中配制溶液需要用到的是
(2)现用质量分数为98%、密度为1.84g·L−1的浓硫酸来配制480mL、0.2mol·L−1的稀硫酸,计算该浓硫酸的物质的量浓度为
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为:②→①→③→⑧→
(4)在配制过程中,下列操作正确的是
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②等稀释后的H2SO4溶液冷却至室温再转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线
您最近半年使用:0次



