名校
解题方法
1 . 现有mg含有Na2O杂质的Na2O2样品,某同学在实验室用如下装置(部分夹持仪器已省略)测定其杂质含量:
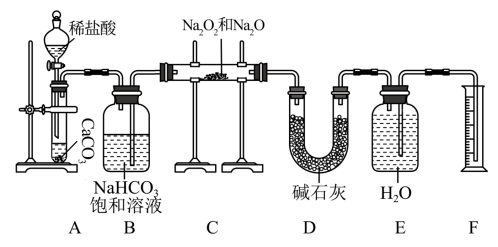
回答下列问题:
(1)装置A中反应的离子方程式为___________ ;该反应基本类型为___________ ,其中CaCO3属于___________ (填“酸”“碱”或“盐”)。
(2)图中有一处明显错误,请指出并改正:___________ 。
(3)装置B的作用是___________ ;装置D的作用是___________ ;若无装置D,样品中杂质的质量分数___________ (填“偏高”“偏低”或“无影响”)。
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:___________ 。
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为___________ (用含m、V的代数式表示,列出计算式即可)。

回答下列问题:
(1)装置A中反应的离子方程式为
(2)图中有一处明显错误,请指出并改正:
(3)装置B的作用是
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为
您最近一年使用:0次
2022-01-18更新
|
110次组卷
|
2卷引用:内蒙古乌兰浩特第一中学2022-2023学年高一上学期期中考试化学试题
2 . 蛋白质在一定条件下反应可将其中的氮元素转化为氨气(NH3)析出。现用上述方法测量某品牌牛奶中蛋白质的含量。具体操作如下:
①配制1.00mol•L-1H2SO4溶液和2.00mol•L-1NaOH溶液
②取30.0g牛奶样品,将所含蛋白质中的氮元素全部转化为氨气
③用2.00mol•L-1的NaOH溶液中和过量的稀硫酸,记录所消耗NaOH溶液的体积
④用25.00mL1.00mol•L-1H2SO4溶液将氨(NH3)完全吸收(NH3+H+=NH )
)
(1)正确的操作顺序是__ (填序号)。
(2)测量过程中步骤③中发生的离子方程式为__ 。
(3)该测定实验共进行了4次.实验室现有50mL,100mL,250mL,500mL4种规格的容量瓶,则配制H2SO4溶液应选用的容量瓶的规格为:__ 。
(4)配制2.00mol•L-1100mL的NaOH溶液(用固体烧碱配制),有以下仪器和用品有:a.烧杯、b.滤纸、c.500mL容量瓶、d药匙、e.胶头滴管、f.托盘天平(带砝码)。
①配制时,不需要使用的仪器和用品有__ (填序号),还缺少的仪器是__ 。
②容量瓶在使用前必须检查__ 。
③下列实验操作会使溶液浓度偏小的是__ 。
a.称量时烧碱固体已潮解
b.容量瓶中有少量蒸馏水
c.在容量瓶中进行定容时俯视刻度线
d.烧杯中溶液未冷却就转移到容量瓶
e.转移溶液后未洗涤烧杯和玻璃棒就直接定容
(5)某同学4次测定所消耗的NaOH溶液的体积如下:
若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为__ 。
①配制1.00mol•L-1H2SO4溶液和2.00mol•L-1NaOH溶液
②取30.0g牛奶样品,将所含蛋白质中的氮元素全部转化为氨气
③用2.00mol•L-1的NaOH溶液中和过量的稀硫酸,记录所消耗NaOH溶液的体积
④用25.00mL1.00mol•L-1H2SO4溶液将氨(NH3)完全吸收(NH3+H+=NH
 )
)(1)正确的操作顺序是
(2)测量过程中步骤③中发生的离子方程式为
(3)该测定实验共进行了4次.实验室现有50mL,100mL,250mL,500mL4种规格的容量瓶,则配制H2SO4溶液应选用的容量瓶的规格为:
(4)配制2.00mol•L-1100mL的NaOH溶液(用固体烧碱配制),有以下仪器和用品有:a.烧杯、b.滤纸、c.500mL容量瓶、d药匙、e.胶头滴管、f.托盘天平(带砝码)。
①配制时,不需要使用的仪器和用品有
②容量瓶在使用前必须检查
③下列实验操作会使溶液浓度偏小的是
a.称量时烧碱固体已潮解
b.容量瓶中有少量蒸馏水
c.在容量瓶中进行定容时俯视刻度线
d.烧杯中溶液未冷却就转移到容量瓶
e.转移溶液后未洗涤烧杯和玻璃棒就直接定容
(5)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V/mL | 19.00 | 19.10 | 19.00 | 18.90 |
若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为
您最近一年使用:0次
2021-12-11更新
|
101次组卷
|
2卷引用:内蒙古自治区赤峰市红山区2021-2022学年高一上学期期末考试化学试题
3 . 在抗击新冠肺炎疫情的战役中,84消毒液发挥着重要作用。实验小组对其进行研究。
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:
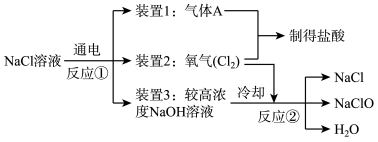
(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是___ 。
(2)写出反应②的化学方程式___ 。
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
实验2:探究84消毒液漂白性的影响因素:
【解释与结论】
(3)实验1的目的是___ 。
(4)实验2得出影响84消毒液失效的因素是___ 。
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是___ 。
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)
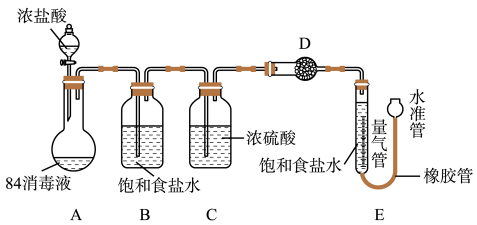
实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作___ 。
(7)装置B的作用是___ ,D中的试剂是___ (填字母序号)。
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是___ (填字母序号)。
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:

(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是
(2)写出反应②的化学方程式
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
| 序号 | 1-1 | 1-2 | 1-3 | 1-4 |
| 实验操作 | 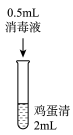 |  |  |  |
| 实验现象 | 实验液体表面产生大量气泡,无其他现象 | 液体中产生大量白色固体 | 液体中产生少量白色固体 | 液体中产生极少量白色固体 |
| 序号 | 2-1 | 2-2 |
| 实验操作 | 取烧杯倒入30mL浓度为1:100的84消毒液,将烧杯放置在距离光源10cm处进行光照,测量ORP变化 | 取四个烧杯,分别倒入30mL浓度为1:100的84消毒液,并置于20℃、30℃、40℃、50℃水溶中加热,测量ORP变化 |
| 测量数据 | 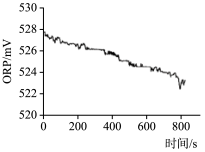 | 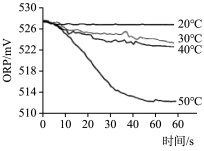 |
(3)实验1的目的是
(4)实验2得出影响84消毒液失效的因素是
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)

实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作
(7)装置B的作用是
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
您最近一年使用:0次
名校
解题方法
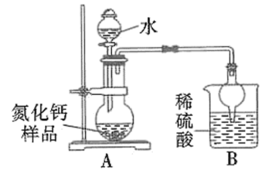
4 . 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是_______ 。
(2)装置A中每生成标准状况下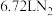 ,转移的电子数为
,转移的电子数为_______ 。
(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为_______ 。
(4)设计实验证明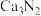 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:_______ 。
II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。
①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是
(2)装置A中每生成标准状况下
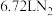 ,转移的电子数为
,转移的电子数为(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为
(4)设计实验证明
 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。

①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
2021-09-16更新
|
252次组卷
|
3卷引用:内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题
解题方法
5 . 在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是___________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是_______________________________________________ 。
乙同学认为是O2,其可能的理由是______________________________________________ 。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_________________ 。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为________________________________________ 。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为________ mol·L-1;铁钉中单质铁的质量分数为____________ 。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是
乙同学认为是O2,其可能的理由是
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 两投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
所配硫酸的物质的量浓度为
您最近一年使用:0次
2020-09-22更新
|
104次组卷
|
2卷引用:内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题
名校
解题方法
6 . I.碳、硫的含量对钢铁性能影响很大,其含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。实验流程如图:
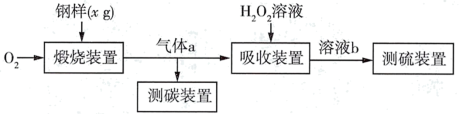
(1)煅烧装置中采用纯氧,目的是_______ 。气体a的主要成分有_____ 、CO2和未反应的O2。
(2)为充分吸收气体a,下列吸收装置中合适的是______ (填标号)。
A.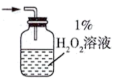 B.
B.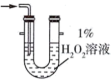
C. D.
D.
(3)气体a被 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。
①滴定时 溶液置于
溶液置于_____ (填仪器名称)中,若以酚酞为指示剂,终点时的现象为_______ 。
②若称取1 g钢样进行实验,滴定消耗 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为_____ 。
(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。
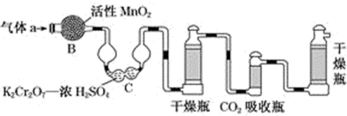
①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是______ 。
②计算钢样中碳的质量分数,应测量的数据是_______ 。
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是______ (填标号)
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为________ 。
(2)电弧炉中生成粗硅,反应的化学方程式为_______ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为___________ 。

(1)煅烧装置中采用纯氧,目的是
(2)为充分吸收气体a,下列吸收装置中合适的是
A.
 B.
B.
C.
 D.
D.
(3)气体a被
 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。①滴定时
 溶液置于
溶液置于②若称取1 g钢样进行实验,滴定消耗
 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。

①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是
②计算钢样中碳的质量分数,应测量的数据是
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为
(2)电弧炉中生成粗硅,反应的化学方程式为
您最近一年使用:0次
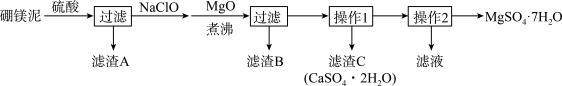
7 . 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___ 。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___ 。
(3)加入MgO后,加热煮沸的目的是___ 。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___ 。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___ 。
(6)获取MgSO4·7H2O的操作2为:___ 、___ 、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___ (能或不能),表达式(或理由)为___ 。

已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
| 温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(2)滤渣A中除含少量CaSO4·2H2O外,还有
(3)加入MgO后,加热煮沸的目的是
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止
(6)获取MgSO4·7H2O的操作2为:
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。
您最近一年使用:0次
2020-04-04更新
|
355次组卷
|
3卷引用:内蒙古呼伦贝尔市海拉尔区2020届高三上学期第一次模拟统一考试理科综合化学试题
名校
8 . 下列关于碱金属及其化合物的叙述错误的是
| A.金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B.干粉灭火器能用于扑灭金属钠、钾的着火 |
| C.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D.Na-K合金用作快中子反应堆的导热剂 |
您最近一年使用:0次
9 . 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________ ;
(2)该注射液中葡萄糖的物质的量浓度为__________ 。(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________ 。

(1)该注射液中葡萄糖的质量分数为
(2)该注射液中葡萄糖的物质的量浓度为
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
解题方法
10 . 化学与人类生活密切相关,现有以下物质:①漂白粉 ②冰醋酸(纯醋酸) ③葡萄糖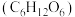 ④胆矾
④胆矾 ⑤干冰 ⑥Cu。请回答下列问题:
⑤干冰 ⑥Cu。请回答下列问题:
(1)以上物质中属于电解质的是________ (填序号)。
(2)医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。
如图是输液用的葡萄糖(相对分子质量为180)注射液的标签。
①该注射液中葡萄糖的物质的量浓度为________ 。
②实验室需要480mL该浓度的葡萄糖溶液,配制该浓度的溶液需要用普通电子天平称量________ g葡萄糖固体。
③配制该溶液需要用到的玻璃仪器除了烧杯和玻璃棒外,还缺少________ 、________ 。
(3)下列操作会使所配制的溶液物质的量浓度偏低的是________(填序号)。
(4)人体血糖(血液中的葡萄糖)正常值为3.9~6.1mmol/L。某人体检报告血糖值检测结果为0.92g/L,则他(她)的血糖值________ (填“偏高”“正常”或“偏低”)。
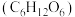 ④胆矾
④胆矾 ⑤干冰 ⑥Cu。请回答下列问题:
⑤干冰 ⑥Cu。请回答下列问题:(1)以上物质中属于电解质的是
(2)医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。
如图是输液用的葡萄糖(相对分子质量为180)注射液的标签。
| 葡萄糖注射液 规格:500mL 密度:1.08g/mL 质量分数:5% 生产批号:10032032 |
②实验室需要480mL该浓度的葡萄糖溶液,配制该浓度的溶液需要用普通电子天平称量
③配制该溶液需要用到的玻璃仪器除了烧杯和玻璃棒外,还缺少
(3)下列操作会使所配制的溶液物质的量浓度偏低的是________(填序号)。
| A.配制溶液所用的容量瓶洗涤后没有干燥 |
| B.转移溶液后,没有洗涤烧杯和玻璃棒 |
| C.定容时俯视刻度线 |
| D.定容时加水超过刻度线,把溶液倒出一些,重新加水至刻度线 |
您最近一年使用:0次
2024-01-12更新
|
80次组卷
|
2卷引用:内蒙古呼和浩特市2023-2024学年高一上学期期末教学质量检测化学试卷



