1 . 在抗击新冠肺炎疫情的战役中,84消毒液发挥着重要作用。实验小组对其进行研究。
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:
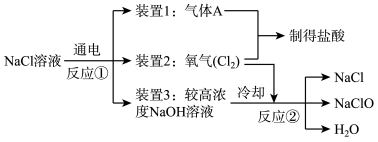
(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是___ 。
(2)写出反应②的化学方程式___ 。
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
实验2:探究84消毒液漂白性的影响因素:
【解释与结论】
(3)实验1的目的是___ 。
(4)实验2得出影响84消毒液失效的因素是___ 。
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是___ 。
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)
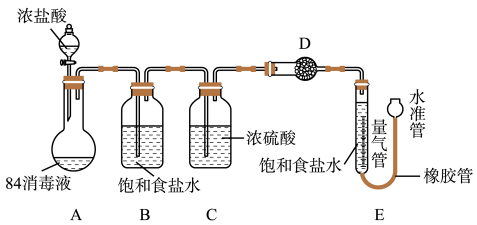
实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作___ 。
(7)装置B的作用是___ ,D中的试剂是___ (填字母序号)。
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是___ (填字母序号)。
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:

(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是
(2)写出反应②的化学方程式
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
| 序号 | 1-1 | 1-2 | 1-3 | 1-4 |
| 实验操作 | 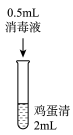 | 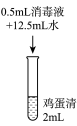 | 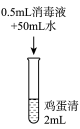 |  |
| 实验现象 | 实验液体表面产生大量气泡,无其他现象 | 液体中产生大量白色固体 | 液体中产生少量白色固体 | 液体中产生极少量白色固体 |
| 序号 | 2-1 | 2-2 |
| 实验操作 | 取烧杯倒入30mL浓度为1:100的84消毒液,将烧杯放置在距离光源10cm处进行光照,测量ORP变化 | 取四个烧杯,分别倒入30mL浓度为1:100的84消毒液,并置于20℃、30℃、40℃、50℃水溶中加热,测量ORP变化 |
| 测量数据 | 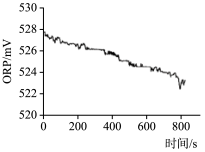 | 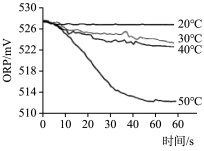 |
(3)实验1的目的是
(4)实验2得出影响84消毒液失效的因素是
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)

实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作
(7)装置B的作用是
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
您最近一年使用:0次
2 . 氯化钠是一种重要的食品添加剂与工业原料,自春秋时期,齐国管仲就提出了“官山海”政策,即对盐实行专卖。秦国商鞅变法,控制山泽之利,也实行食盐专卖。
(1)实验室现需要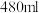

 溶液,配制时使用容量瓶的规格为
溶液,配制时使用容量瓶的规格为___________ ;下列操作会使所配溶液浓度偏低的是___________ (填标号)。
a.容量瓶洗涤干净后未放入加热烘箱干燥
b.定容、摇匀后发现液面下降,再加适量的蒸馏水
c.在定容时俯视容量瓶上的刻度线
d.初次转移溶液后,未洗涤烧杯和玻璃棒
(2)粗盐中常含有少量的 Ca2+、Mg2+、 等杂质离子,可采用如图的工序来纯化。
等杂质离子,可采用如图的工序来纯化。___________ 、___________ 的方法。
②试剂a中包含多种物质,按滴加顺序依次是NaOH、___________ 、___________ (填化学式)。要在实验室中完成“过滤”操作,需要的玻璃仪器包括烧杯、玻璃棒、___________ 。
③要检验产品中是否存在 ,需要进行的操作是
,需要进行的操作是___________ 。
④某工厂因工艺不佳,其最终的产品中混入了少量的FeCl3,已知FeCl3与 Na2EDTA可发生反应 (产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是
(产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是___________ (保留两位有效数字)。
(1)实验室现需要
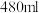

 溶液,配制时使用容量瓶的规格为
溶液,配制时使用容量瓶的规格为a.容量瓶洗涤干净后未放入加热烘箱干燥
b.定容、摇匀后发现液面下降,再加适量的蒸馏水
c.在定容时俯视容量瓶上的刻度线
d.初次转移溶液后,未洗涤烧杯和玻璃棒
(2)粗盐中常含有少量的 Ca2+、Mg2+、
 等杂质离子,可采用如图的工序来纯化。
等杂质离子,可采用如图的工序来纯化。
②试剂a中包含多种物质,按滴加顺序依次是NaOH、
③要检验产品中是否存在
 ,需要进行的操作是
,需要进行的操作是④某工厂因工艺不佳,其最终的产品中混入了少量的FeCl3,已知FeCl3与 Na2EDTA可发生反应
 (产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是
(产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是
您最近一年使用:0次
名校
解题方法
3 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研究型学习小组同学测定某地黑木耳中铁的含量。
(1)称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。高温灼烧黑木耳,使之完全灰化。将木耳灰用下图流程处理,对滤液中的溶质进行研究。
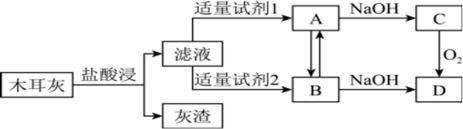
①浸泡液检测不出铁元素的原因是_______ 。
②试剂l应该是_______ 。
(2)A转化为B可加入的试剂有_______ 。
a.酸性高锰酸钾 b.Cl2 c.H2O2溶液
(3)C生成D时的反应现象为_______ 。
(4)已知在酸性条件下Fe2+可被氧气氧化为Fe3+,该反应每转移8mol电子,标准状况下消耗氧气的体积为_______ L。
(1)称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。高温灼烧黑木耳,使之完全灰化。将木耳灰用下图流程处理,对滤液中的溶质进行研究。

①浸泡液检测不出铁元素的原因是
②试剂l应该是
(2)A转化为B可加入的试剂有
a.酸性高锰酸钾 b.Cl2 c.H2O2溶液
(3)C生成D时的反应现象为
(4)已知在酸性条件下Fe2+可被氧气氧化为Fe3+,该反应每转移8mol电子,标准状况下消耗氧气的体积为
您最近一年使用:0次
解题方法
4 . 某厂为了测定一批Cu-Mg样品中铜的质量分数,取用10g样品,把200g稀盐酸分4次加入样品中(样品中除Cu-Mg外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如表:
(1)该样品中铜的质量分数是___ 。
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)___ 。
| 稀盐酸的用量 | 第一次加入50g | 第二次加入50g | 第三次加入50g | 第四次加入50g |
| 剩余固体的质量 | 8.8g | 7.6g | 6.4g | 6.4g |
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)
您最近一年使用:0次
名校
解题方法
5 . W、X、Y、Z是原子序数依次增大的短周期主族元素,W与X、Y、Z不同周期,W为地壳中含量最多的元素,Y与W同主族,X的原子半径在短周期主族元素中是最大的。下列说法正确的是
| A.简单离子半径:X>Y>W |
| B.W与X形成的化合物中阴阳离子个数比为1∶1 |
| C.最简单氢化物的热稳定性:W<Y |
| D.Z形成的单质可用于自来水消毒 |
您最近一年使用:0次
2023-02-21更新
|
182次组卷
|
3卷引用:内蒙古乌兰浩特市第四中学2022-2023学年高一下学期开学考试化学试题
名校
解题方法
6 . A~G为中学常见的物质,其中A~F中含有同一种金属元素,各物质间有如下转化关系。其中B、G为地壳中含量排前两位的金属单质,D、F为碱,C、E为仅含两种元素的盐(部分条件已省略)。
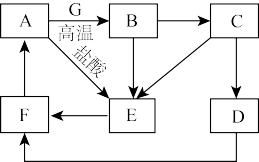
回答下列问题:
(1)A的化学式为___________ ;E溶液的颜色为___________ 色。
(2)E转化为F的离子方程式为___________ 。
(3)在溶液中D转化为F的现象为___________ 。
(4)某同学在老师的指导下展开了延伸学习,配制480mL C溶液。
C溶液。
①在配制C溶液时需加入少量铁屑,其目的是___________ 。
②在配制过程中,下列错误操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:___________ ;
b、烧杯和玻璃棒未洗涤:___________ ;
c、定容时俯视刻度线:___________ 。

回答下列问题:
(1)A的化学式为
(2)E转化为F的离子方程式为
(3)在溶液中D转化为F的现象为
(4)某同学在老师的指导下展开了延伸学习,配制480mL
 C溶液。
C溶液。①在配制C溶液时需加入少量铁屑,其目的是
②在配制过程中,下列错误操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:
b、烧杯和玻璃棒未洗涤:
c、定容时俯视刻度线:
您最近一年使用:0次
2023-01-07更新
|
198次组卷
|
4卷引用:内蒙古乌兰浩特市第四中学2022-2023学年高一下学期开学考试化学试题
名校
解题方法
7 . X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Y在元素周期表中的位置是___ 。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是___ 。
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为___ 。
(4)元素X的金属性比元素Y___ (填“强”或“弱”),用原子结构的知识解释原因___ 。
(5)元素Q、元素Z的含量影响钢铁性能,采用如图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。

①气体a的成分是__ (填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是___ 。
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为
(4)元素X的金属性比元素Y
(5)元素Q、元素Z的含量影响钢铁性能,采用如图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。

①气体a的成分是
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是
您最近一年使用:0次



