名校
解题方法
1 . 碳酸氢钠俗称小苏打,在医疗、食品、橡胶工业中有广泛应用。
(1)甲同学向饱和NaCl溶液中先通NH3再通入CO2,充分反应后得到NaHCO3晶体和另一种不含金属元素的盐,请补充完整该反应方程式。
NaCl+NH3+CO2+H2O=NaHCO3↓+______ 。
乙同学认为甲同学获得的NaHCO3晶体中含有NaCl等与酸不反应的杂质。为测定NaHCO3的质量分数,他设计了以下两种方案:
方案一:滴定法
称取8.2g样品溶于水,逐滴加入2.3mol•L-1稀硫酸,待完全反应时,测定所消耗稀硫酸的体积。
(2)配制100mL2.3mol•L-1的稀硫酸。
①若用18.4mol•L-1浓硫酸配制,需量取浓硫酸______ mL。
②配制过程中不需要用到的仪器是______ (填字母)。
A. B.
B. C.
C.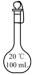 D.
D.
③下列情况会导致所配制溶液浓度偏低的是______ 。
A.没有洗涤烧杯和玻璃棒
B.定容时俯视刻度线
C.容量瓶清洗后残留有少量蒸馏水
D.如果加水超过了刻度线,吸出液体使液面恰好到刻度线
(3)乙同学在用硫酸滴定样品测定含量时,在保证测定结果数值变化不大的情况下,一共进行3次测定,这样做的目的是______ 。
方案二:称量法乙同学按如图操作流程进行测定。
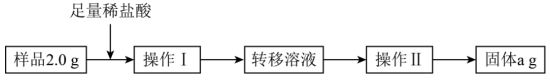
(4)操作Ⅰ后所得溶液的主要溶质的化学式是______ 。
(5)操作Ⅱ的名称是______ 。
(1)甲同学向饱和NaCl溶液中先通NH3再通入CO2,充分反应后得到NaHCO3晶体和另一种不含金属元素的盐,请补充完整该反应方程式。
NaCl+NH3+CO2+H2O=NaHCO3↓+
乙同学认为甲同学获得的NaHCO3晶体中含有NaCl等与酸不反应的杂质。为测定NaHCO3的质量分数,他设计了以下两种方案:
方案一:滴定法
称取8.2g样品溶于水,逐滴加入2.3mol•L-1稀硫酸,待完全反应时,测定所消耗稀硫酸的体积。
(2)配制100mL2.3mol•L-1的稀硫酸。
①若用18.4mol•L-1浓硫酸配制,需量取浓硫酸
②配制过程中不需要用到的仪器是
A.
 B.
B. C.
C. D.
D.
③下列情况会导致所配制溶液浓度偏低的是
A.没有洗涤烧杯和玻璃棒
B.定容时俯视刻度线
C.容量瓶清洗后残留有少量蒸馏水
D.如果加水超过了刻度线,吸出液体使液面恰好到刻度线
(3)乙同学在用硫酸滴定样品测定含量时,在保证测定结果数值变化不大的情况下,一共进行3次测定,这样做的目的是
方案二:称量法乙同学按如图操作流程进行测定。

(4)操作Ⅰ后所得溶液的主要溶质的化学式是
(5)操作Ⅱ的名称是
您最近一年使用:0次
解题方法
2 . 现有一块铝、铁合金,欲测定其铝含量,切取4.8g合金溶于盐酸中,再加入过量的NaOH溶液,滤出沉淀,将沉淀在空气中充分灼烧,最后得到4.8g红棕色粉末,则此合金中Al的质量分数约为
| A.12% | B.30% | C.48% | D.70% |
您最近一年使用:0次
2023-02-18更新
|
139次组卷
|
3卷引用:黑龙江省齐齐哈尔市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
3 . 探究题以废铁屑(含少量Fe2O3、FeS等杂质)为原料,制备硫酸亚铁晶体(FeSO4·7H2O),流程示意图如下。
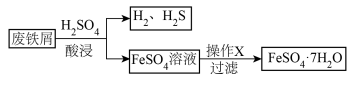
已知: 晶体受热易失水。
晶体受热易失水。
(1)酸浸过程中,H2SO4的作用是FeS+2H+=Fe2++H2S↑、Fe+2H+=Fe2++H2↑、_______ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
① 时检验,溶液变红,说明所得溶液中含有
时检验,溶液变红,说明所得溶液中含有_______ 。
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因_______ 。
③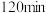 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因_______ 。
④操作X是_______ 。
(3)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取ag硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入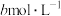 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液cmL。
溶液cmL。
计算硫酸亚铁晶体样品中 的质量分数
的质量分数_______ 。

已知:
 晶体受热易失水。
晶体受热易失水。(1)酸浸过程中,H2SO4的作用是FeS+2H+=Fe2++H2S↑、Fe+2H+=Fe2++H2↑、
(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  | 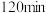 |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
①
 时检验,溶液变红,说明所得溶液中含有
时检验,溶液变红,说明所得溶液中含有②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
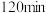 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因④操作X是
(3)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取ag硫酸亚铁晶体样品,配制成
 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入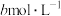 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液cmL。
溶液cmL。计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
名校
4 . 过氧化钙( )是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在 溶液中加入
溶液中加入 ;
;
②不断搅拌的同时加入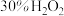 ,反应生成
,反应生成 沉淀;
沉淀;
③经过陈化、过滤,水洗得到 ,再脱水干燥得到
,再脱水干燥得到 。
。
已知 在350℃迅速分解生成
在350℃迅速分解生成 和
和 。下图是实验室测定产品中
。下图是实验室测定产品中 含量的装置(夹持装置省略)。
含量的装置(夹持装置省略)。
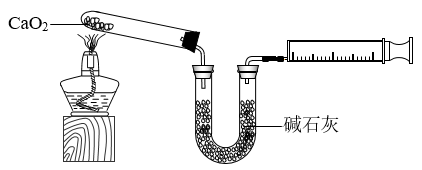
(1)第②步反应的化学方程式为___________ 。
(2) 加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是___________ 、___________ 。
(3)若所取产品质量是 ,测得气体体积为
,测得气体体积为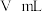 (已换算成标准状况),则产品中
(已换算成标准状况),则产品中 的质量分数为
的质量分数为___________ (用字母表示)。
(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取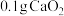 产品于锥形瓶中,加入
产品于锥形瓶中,加入 蒸馏水和
蒸馏水和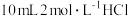 ,完全溶解后加入几滴
,完全溶解后加入几滴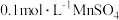 溶液,用
溶液,用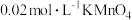 标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
①反应加入 溶液的作用是
溶液的作用是___________ ,滴定的终点现象是___________ 。
②滴定过程中加入标准溶液发生反应的离子方程式为___________ ,过氧化钙的质量分数为___________ (保留两位有效数字)。
 )是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:①在
 溶液中加入
溶液中加入 ;
;②不断搅拌的同时加入
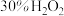 ,反应生成
,反应生成 沉淀;
沉淀;③经过陈化、过滤,水洗得到
 ,再脱水干燥得到
,再脱水干燥得到 。
。已知
 在350℃迅速分解生成
在350℃迅速分解生成 和
和 。下图是实验室测定产品中
。下图是实验室测定产品中 含量的装置(夹持装置省略)。
含量的装置(夹持装置省略)。
(1)第②步反应的化学方程式为
(2)
 加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是(3)若所取产品质量是
 ,测得气体体积为
,测得气体体积为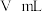 (已换算成标准状况),则产品中
(已换算成标准状况),则产品中 的质量分数为
的质量分数为(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取
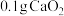 产品于锥形瓶中,加入
产品于锥形瓶中,加入 蒸馏水和
蒸馏水和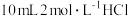 ,完全溶解后加入几滴
,完全溶解后加入几滴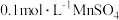 溶液,用
溶液,用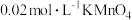 标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
标准溶液滴定至终点。平行三次,所得实验数据如下表所示:| 试验次数 | 一 | 二 | 三 |
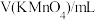 | 23.02 | 23.05 | 23.04 |
 溶液的作用是
溶液的作用是②滴定过程中加入标准溶液发生反应的离子方程式为
您最近一年使用:0次
5 . 为了测定镁铝合金中各成分金属的含量,可采取以下两种方法:
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为_______ 。
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为____ (保留三位有效数字),合金中镁铝的物质的量之比____ 。
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 2.55 | 3.85 | 4.59 |
| 生成气体体积/L | 2.80 | 3.36 | 3.36 |
则盐酸的物质的量浓度为
您最近一年使用:0次
名校
6 . 为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如图实验:

(1)上述实验过程中发生反应的化学方程式为______ 。
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式___ 。
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为40%的氢氧化钾溶液的质量为___ 。
(4)样品中硫酸铜的质量分数为___ 。
(5)D烧杯溶液中溶质的质量分数为____ 。
(6)若用湿法治金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为多少?(写出计算过程)____

(1)上述实验过程中发生反应的化学方程式为
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为40%的氢氧化钾溶液的质量为
(4)样品中硫酸铜的质量分数为
(5)D烧杯溶液中溶质的质量分数为
(6)若用湿法治金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为多少?(写出计算过程)
您最近一年使用:0次
名校
7 . 下列说法不正确的是
A.某硝酸密度为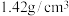 ,质量分数为 ,质量分数为 ,此硝酸物质的量浓度为 ,此硝酸物质的量浓度为 |
B.将物质的量浓度为 、质量分数为 、质量分数为 的硫酸溶液,加水稀释至物质的量浓度为 的硫酸溶液,加水稀释至物质的量浓度为 ,质量分数变为 ,质量分数变为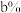 ,则 ,则 |
C. 溶液和 溶液和 溶液, 溶液, 的物质的量不同 的物质的量不同 |
D. 溶液中含 溶液中含 ,则溶液中的 ,则溶液中的 物质的量浓度为 物质的量浓度为 |
您最近一年使用:0次
名校
8 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 质量分数为 质量分数为 的乙醇 的乙醇 水溶液中所含氢原子数为 水溶液中所含氢原子数为 |
B.将含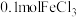 的饱和溶液滴入沸水中,产生的 的饱和溶液滴入沸水中,产生的 胶体粒子数为 胶体粒子数为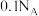 |
C.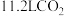 和 和 的混合气体中含有原子数 的混合气体中含有原子数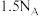 |
D.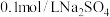 溶液中,含有的 溶液中,含有的 数为 数为 |
您最近一年使用:0次
解题方法
9 . 黄铜矿主要成分为 ,某研究团队利用氧化亚铁硫杆菌溶浸,通过系列操作可获得铜和硫酸铁铵晶体。工艺流程如下:
,某研究团队利用氧化亚铁硫杆菌溶浸,通过系列操作可获得铜和硫酸铁铵晶体。工艺流程如下:
(1)“溶浸”时,需要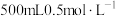 硫酸溶液,在配制硫酸溶液时:所需质量分数为98%、密度为
硫酸溶液,在配制硫酸溶液时:所需质量分数为98%、密度为 的浓硫酸的体积为
的浓硫酸的体积为______ mL(计算结果保留一位小数),“溶浸”时被氧化的元素为_______ (填元素符号)。
(2)“分离Cu”时,Fe与 反应的离子方程式为
反应的离子方程式为________ ,该过程中分离出Fe、Cu的操作名称为_______ 。
(3)“氧化”时,温度不能太高,原因是________ ,反应过程中,参加反应的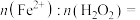
______ 。
(4)硫酸铁铵晶体[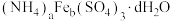 ]组成的测定
]组成的测定
步骤1:准确称取质量为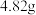 固体在酸性条件下溶于水配成
固体在酸性条件下溶于水配成 溶液A;
溶液A;
步骤2:取 溶液A,加入足量的
溶液A,加入足量的 溶液,过滤得
溶液,过滤得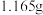 沉淀;
沉淀;
步骤3:取 溶液A,加入足量氢氧化钠溶液,过滤,洗涤并灼烧得
溶液A,加入足量氢氧化钠溶液,过滤,洗涤并灼烧得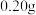 固体。
固体。
通过上述步骤,计算确定该晶体的化学式为___________ 。
 ,某研究团队利用氧化亚铁硫杆菌溶浸,通过系列操作可获得铜和硫酸铁铵晶体。工艺流程如下:
,某研究团队利用氧化亚铁硫杆菌溶浸,通过系列操作可获得铜和硫酸铁铵晶体。工艺流程如下: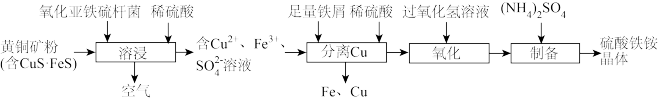
(1)“溶浸”时,需要
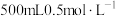 硫酸溶液,在配制硫酸溶液时:所需质量分数为98%、密度为
硫酸溶液,在配制硫酸溶液时:所需质量分数为98%、密度为 的浓硫酸的体积为
的浓硫酸的体积为(2)“分离Cu”时,Fe与
 反应的离子方程式为
反应的离子方程式为(3)“氧化”时,温度不能太高,原因是
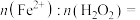
(4)硫酸铁铵晶体[
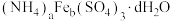 ]组成的测定
]组成的测定步骤1:准确称取质量为
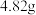 固体在酸性条件下溶于水配成
固体在酸性条件下溶于水配成 溶液A;
溶液A;步骤2:取
 溶液A,加入足量的
溶液A,加入足量的 溶液,过滤得
溶液,过滤得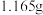 沉淀;
沉淀;步骤3:取
 溶液A,加入足量氢氧化钠溶液,过滤,洗涤并灼烧得
溶液A,加入足量氢氧化钠溶液,过滤,洗涤并灼烧得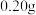 固体。
固体。通过上述步骤,计算确定该晶体的化学式为
您最近一年使用:0次
2024-01-30更新
|
155次组卷
|
3卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一下学期开学化学试题
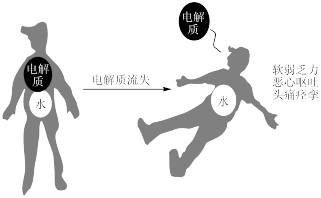
10 . 电解质在人体内的作用是十分重要的,当电解质紊乱时人体就会出现一系列不适症状,甚至危及生命。 固体④漂白粉粉末 ⑤熔融的
固体④漂白粉粉末 ⑤熔融的 ⑥
⑥ 溶液
溶液
(1)上述物质中,属于电解质的是___________ (填序号,下同),能导电的是___________ 。
(2)16.8g由 和
和 组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
(3)将①投入⑥的溶液中产生气泡,写出离子方程式___________ 。
Ⅱ.完成下列问题
(4)配制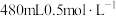 的
的 溶液。
溶液。
①配制时,用托盘天平称取 固体的质量为
固体的质量为___________ g
②其操作步骤如下图所示:___________ (填序号)操作之间。___________ (填字母序号)。
a.定容时俯视刻度线
b.溶解时,烧杯中有少量蒸馏水
c.加水时不慎超过了刻度线,立即用胶头滴管吸出
(5)从配制好的 溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中
溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中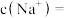
___________  。
。
 固体④漂白粉粉末 ⑤熔融的
固体④漂白粉粉末 ⑤熔融的 ⑥
⑥ 溶液
溶液(1)上述物质中,属于电解质的是
(2)16.8g由
 和
和 组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。| A.8g | B.15.5g | C.11.7g | D.23.4g |
(3)将①投入⑥的溶液中产生气泡,写出离子方程式
Ⅱ.完成下列问题
(4)配制
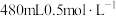 的
的 溶液。
溶液。①配制时,用托盘天平称取
 固体的质量为
固体的质量为②其操作步骤如下图所示:
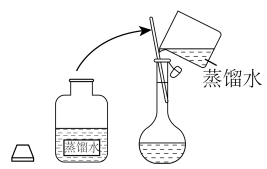
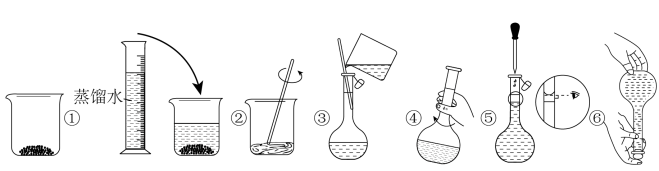
a.定容时俯视刻度线
b.溶解时,烧杯中有少量蒸馏水
c.加水时不慎超过了刻度线,立即用胶头滴管吸出
(5)从配制好的
 溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中
溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中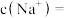
 。
。
您最近一年使用:0次
2023-12-24更新
|
76次组卷
|
2卷引用:黑龙江省齐齐哈尔市克东县第一中学2023-2024学年高一下学期开学考试化学试题



