解题方法
1 . 铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
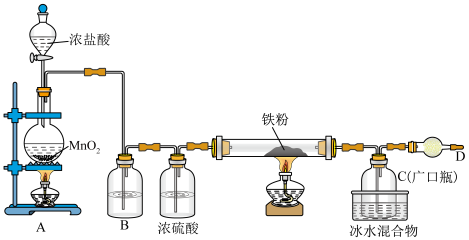
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是_______ 。
(2)A中发生反应的离子方程式为________________________________________ 。
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是_______ 。
(4)过量铁粉与氯气,加热条件下反应的化学方程式为__________________________ 。
(5)D中装的药品是碱石灰,其作用是___________________________________________ 。
(6)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于c(H+)低所致。
猜想②:是由于_______ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想_______ 成立。
(7)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为_______ %(结果精确到小数点后两位)。

查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是
(2)A中发生反应的离子方程式为
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是
(4)过量铁粉与氯气,加热条件下反应的化学方程式为
(5)D中装的药品是碱石灰,其作用是
(6)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于c(H+)低所致。
猜想②:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(7)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 短周期主族元素X、Y、Z、M、N、Q的原子序数依次增大,其中X的一种原子无中子,Y、N同主族,Y的最外层电子数是周期数的3倍,Z与Y的核电荷数之差为3,M是地壳中含量最多的金属。回答下列问题:
(1)N在元素周期表中的位置是___________ ,Y的离子结构示意图为___________ 。
(2)Y、M、N三种元素所形成的简单离子,半径由大到小的顺序是___________ (填化学式,下同)。N、Q的简单氢化物热稳定性较差的是___________ 。
(3)X、Y、Z形成的化合物中化学键类型为___________ 。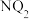 的电子式为
的电子式为___________ 。
(4)实验室检验Z简单离子的方法是___________ 。
(5) M最高价氧化物对应的水化物分别与Z、Q最高价氧化物对应的水化物反应的离子方程式为___________ 、___________ 。
(1)N在元素周期表中的位置是
(2)Y、M、N三种元素所形成的简单离子,半径由大到小的顺序是
(3)X、Y、Z形成的化合物中化学键类型为
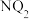 的电子式为
的电子式为(4)实验室检验Z简单离子的方法是
(5) M最高价氧化物对应的水化物分别与Z、Q最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
2024-03-02更新
|
146次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一下学期开学化学试题
名校
解题方法
3 . 84消毒液是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、医院、食品加工行业、家庭等的卫生消毒。某84消毒液瓶体部分标签如表所示,该84消毒液通常稀释100倍(体积比)后使用。请回答下列问题:
(1)此“84消毒液”的物质的量浓度约为___________ mol/L。(计算结果保留一位小数)
(2)某同学量取100 mL此84消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=__________ mol/L。
(3)该同学阅读该84消毒液的配方后,欲用NaClO固体配制480 mL NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是___________ (填字母),还缺少的玻璃仪器是___________ 。

②下列操作中,容量瓶不具备的功能是___________ (填字母)。
a.准确配制一定体积浓度的标准溶液
b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液
d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
③该同学配制此溶液需用托盘天平称取NaClO固体的质量为___________ g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是_________ (填字母)。
A.定容时俯视刻度线
B.转移前,容量瓶内有蒸馏水
C.未冷却至室温就转移定容
D.定容时加水过量,用胶头滴管吸出
| 84消毒液 [有效成分]NaClO [规格]1000 mL [质量分数]24% [密度]1.18 g/cm3 |
(2)某同学量取100 mL此84消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=
(3)该同学阅读该84消毒液的配方后,欲用NaClO固体配制480 mL NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是

②下列操作中,容量瓶不具备的功能是
a.准确配制一定体积浓度的标准溶液
b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液
d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
③该同学配制此溶液需用托盘天平称取NaClO固体的质量为
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是
A.定容时俯视刻度线
B.转移前,容量瓶内有蒸馏水
C.未冷却至室温就转移定容
D.定容时加水过量,用胶头滴管吸出
您最近一年使用:0次
2021-02-02更新
|
191次组卷
|
13卷引用:吉林省长春外国语学校2023-2024学年高一下学期开学化学试题
吉林省长春外国语学校2023-2024学年高一下学期开学化学试题山东省枣庄市第二中学2020届高三上学期第一次阶段性检测化学试题(已下线)【南昌新东方】 莲塘一中化学高一9月份(已下线)【南昌新东方】2019莲塘一中 高一上第一次月考甘肃省兰州市第五十九中学2019-2020学年高一上学期期中考试化学试题新疆维吾尔自治区阿勒泰地区2019-2020学年高二下学期期末考试化学试题(A卷)山东省德州市齐河县实验中学2021届高三第一次月考化学试题(已下线)【南昌新东方】4. 一中,铁一,十中联考 左佳鑫安徽省滁州市定远县重点中学2020-2021学年高一上学期期末考试化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】河北省雄县第一高级中学2021-2022学年高一上学期10月考化学试题辽宁省沈阳市第八十三中学2021-2022学年高二下学期6月复学考试化学试题广东省广州市第二中学2022-2023学年高一上学期12月月考化学试题
4 . 在标况下,将a gNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/mL,质量分数为W,下列叙述正确的是
A.溶质的物质的量浓度c= mol/L mol/L |
B.溶质的质量分数W=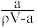 ×100% ×100% |
C.该气体的体积约为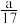 ×22.4 L ×22.4 L |
| D.向上述溶液中加入VmL水,所得溶液的质量分数大于0.5w |
您最近一年使用:0次
解题方法
5 . 实验室模拟高温煅烧石灰石的方法制取二氧化碳,取35 g石灰石样品(假设杂质受热不分解,且不与酸反应),煅烧一段时间恢复到室温,测得生成11 g二氧化碳。向剩余固体中逐滴加入某盐酸至不再反应为止,又生成2.2 g二氧化碳,加入盐酸的质量与生成的氯化钙质量关系如图:
(1)石灰石样品的质量分数是_______ (结果保留一位小数,下同);
(2)a点溶液的pH_____ 7(填“<”“>”或“=”);
(3)求所加盐酸的溶质质量分数_____ (写出计算过程)。
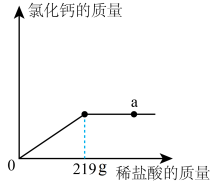
(1)石灰石样品的质量分数是
(2)a点溶液的pH
(3)求所加盐酸的溶质质量分数

您最近一年使用:0次
2020-08-06更新
|
39次组卷
|
2卷引用:吉林省农安县哈拉海中学2019-2020学年高一上学期开学考试化学试题
名校
解题方法
6 . 某同学欲用NaOH固体配制480mL质量分数为25%,密度为1.2g/mL的溶液。下列叙述不正确的是( )
| A.需用托盘天平称量NaOH固体的质量为144g |
| B.容量瓶用蒸馏水洗净后,不必烘干就能用于配制溶液 |
| C.定容时俯视容量瓶的刻度线,会造成所配溶液的物质的量浓度偏高 |
| D.该溶液的物质的量的浓度为7.5mol/L |
您最近一年使用:0次
2020-09-05更新
|
421次组卷
|
6卷引用:吉林省吉化第一高级中学校2019-2020学年高一9月月考化学试题
名校
7 . 二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
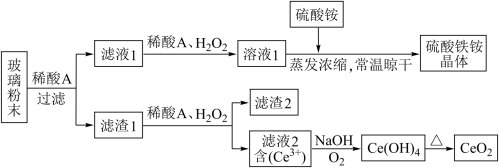
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________ 。
(2)滤液1中加入H2O2溶液的目的是____________________ 。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________ 。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________ 。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________ 。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________ 。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________ (结果保留两位有效数字)。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是
(2)滤液1中加入H2O2溶液的目的是
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式
(5)由滤液2生成Ce(OH)4的离子方程式
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性。G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____ 。
(2)D单质与C单质在加热条件下反应产物的电子式____ ,该物质与A的氧化物反应产生氧气,离子方程式为_____ 。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为____ 。
(4)G单质在一定条件下可以和A2C反应,方程式为_______ 。
(5)用电子式写出A2C的形成过程_______ 。
(1)E的原子结构示意图:
(2)D单质与C单质在加热条件下反应产物的电子式
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为
(4)G单质在一定条件下可以和A2C反应,方程式为
(5)用电子式写出A2C的形成过程
您最近一年使用:0次
9 . 某容器中发生一个化学反应,反应过程中存在Fe2+、 、Fe3+、
、Fe3+、 、H+和水六种粒子,在反应过程中测得Fe3+、
、H+和水六种粒子,在反应过程中测得Fe3+、 的含量随时间变化的曲线如图所示,下列判断错误的是
的含量随时间变化的曲线如图所示,下列判断错误的是
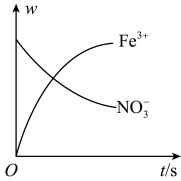
 、Fe3+、
、Fe3+、 、H+和水六种粒子,在反应过程中测得Fe3+、
、H+和水六种粒子,在反应过程中测得Fe3+、 的含量随时间变化的曲线如图所示,下列判断错误的是
的含量随时间变化的曲线如图所示,下列判断错误的是 
A. 被还原,发生还原反应 被还原,发生还原反应 |
B.还原性:Fe2+> |
| C.该反应中Fe2+被氧化为Fe3+ |
| D.还原剂与氧化剂的个数之比为6∶1 |
您最近一年使用:0次
2021-08-26更新
|
3023次组卷
|
24卷引用:吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题
吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题吉林省长春市十一高中2021-2022学年高一上学期第一学程考试化学试题甘肃省兰州师范大学附属中学2019-2020学年高一上学期期中考试化学试题宁夏石嘴山市第三中学2020-2021学年高一上学期第二次月考化学试题四川省成都邛崃市高埂中学2020-2021学年高一下学期开学考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高一下学期第一次考试化学试题第3课时 氧化还原反应的基本规律和配平(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)江西省靖安中学2020-2021学年高一上学期第二次月考化学试题安徽省明光中学2021-2022学年高一上学期第一次月考化学试题湖北省罗田第一中学2021-2022学年高一10月月考化学试题辽宁省沈阳市一二〇中学2021-2022学年高一上学期第一次月考化学试题江西省高安中学2021-2022学年高一上学期期中考试化学试题四川省广安市武胜烈面中学校2021-2022学年高一上学期期中测试化学试题浙江省金华市第一中学2021-2022学年高一上学期期初摸底考试化学试题第一章 物质及其变化黑龙江省哈尔滨市第一中学2021-2022学年高一上学期期中考试化学试题 河南省豫东名校2022--2023学年高一上学期第一次联合调研考试化学试卷广东省广州市铁一中学2022-2023学年高一上学期期中考试化学试题广东省广州市铁一中学2022-2023学年高一上学期期中考试化学试题江苏省海安市实验中学2022-2023学年高一上学期11月期中考试化学试题河北省张家口市宣化第一中学2022-2023学年高一上学期12月月考化学试题广东省广州市三校(广附,铁一,广外)2023-2024学年高一上学期期末联考化学试题宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题广东省江门市第一中学2023-2024学年高一下学期开学考化学试题
10 . 下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中,A、D为金属单质,A 是地壳中含量最多的金属。(反应过程中生成的水及其它产物已略去),D的合金目前用量最大用途最广。请回答以下问题:
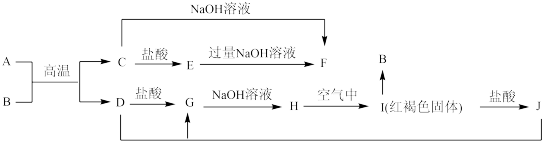
(1)C是_______ ,H是_______ (填化学式)。
(2)写出J与D反应转化为G的离子方程式:_______ 。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式:_______ 。
(4)写出H在空气中生成I对应方程式_______ 。
(5)写出一种B的用途_______ 。

(1)C是
(2)写出J与D反应转化为G的离子方程式:
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式:
(4)写出H在空气中生成I对应方程式
(5)写出一种B的用途
您最近一年使用:0次



