2014·陕西西安·二模
名校
1 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
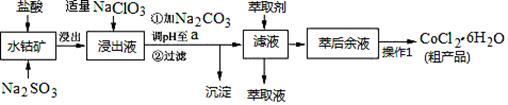
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_________________ 。
(2)写出NaClO3发生反应的主要离子方程式________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为___________________ 。
(4)“操作1”中包含3个基本实验操作,它们依次是_____________ 、____________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是______________ ;其使用的最佳pH范围是_________ 。
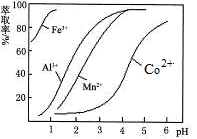
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为
(4)“操作1”中包含3个基本实验操作,它们依次是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
6卷引用:2017届湖北省襄阳五中高三上8月开学考化学试卷
2 . 我国科学家侯德榜发明了联合制碱法。以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业作出了卓越贡献。根据要求回答下列问题:
I、用纯净的碳酸钠固体配制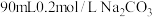 溶液。
溶液。
(1)用托盘天平称取 固体的质量是
固体的质量是_____ 
(2)本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和_____ 。
(3)下列说法中,正确的是_____(填字母)。
II、生成纯碱的流程如下: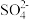 、
、 、
、 ,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量
,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量 溶液;②足量
溶液;②足量 溶液;③适量稀盐酸;④足量的
溶液;③适量稀盐酸;④足量的 溶液。则正确的试剂添加顺序_____(填字母)。
溶液。则正确的试剂添加顺序_____(填字母)。
(5)已知:
写出装置I中反应的化学方程式:_____ 。
(6)制出的纯碱中只含有杂质 ,下列实验方案中,不能测定出混合物中
,下列实验方案中,不能测定出混合物中 质量分数的是_____(填字母)。
质量分数的是_____(填字母)。
(7)将碳酸钠和碳酸氢钠的混合物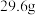 ,加热到质量不再变化时,剩余物质的质量
,加热到质量不再变化时,剩余物质的质量 ,则混合物中碳酸钠的质量分数
,则混合物中碳酸钠的质量分数_____  (精确到0.1)。
(精确到0.1)。
I、用纯净的碳酸钠固体配制
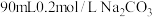 溶液。
溶液。(1)用托盘天平称取
 固体的质量是
固体的质量是
(2)本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
(3)下列说法中,正确的是_____(填字母)。
| A.定容时仰视刻度线,会导致配制的溶液浓度偏小 |
| B.定容时如果加水超过刻度线,要用滴管吸出 |
| C.摇匀后发现凹液面下降,再加水至刻度线 |
| D.转移时溶液倒出容量瓶外,要重新配制溶液 |
II、生成纯碱的流程如下:

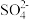 、
、 、
、 ,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量
,依次加入的试剂是_____、_____、_____、过滤、_____。备用的除杂试剂有:①足量 溶液;②足量
溶液;②足量 溶液;③适量稀盐酸;④足量的
溶液;③适量稀盐酸;④足量的 溶液。则正确的试剂添加顺序_____(填字母)。
溶液。则正确的试剂添加顺序_____(填字母)。| A.①②③④ | B.②①④③ | C.②④①③ | D.④②①③ |
(5)已知:
 |  |  |  | |
| 溶解度(20℃) | 36.0 | 21.7 | 9.6 | 37.2 |
(6)制出的纯碱中只含有杂质
 ,下列实验方案中,不能测定出混合物中
,下列实验方案中,不能测定出混合物中 质量分数的是_____(填字母)。
质量分数的是_____(填字母)。A.取 混合物充分加热,质量减少 混合物充分加热,质量减少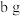 |
B.取 混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到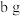 固体 固体 |
C.取 混合物与足量 混合物与足量 溶液充分反应,沉淀经过滤、洗涤、干燥得到 溶液充分反应,沉淀经过滤、洗涤、干燥得到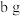 固体 固体 |
D.取 混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加 混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加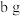 |
(7)将碳酸钠和碳酸氢钠的混合物
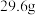 ,加热到质量不再变化时,剩余物质的质量
,加热到质量不再变化时,剩余物质的质量 ,则混合物中碳酸钠的质量分数
,则混合物中碳酸钠的质量分数 (精确到0.1)。
(精确到0.1)。
您最近一年使用:0次
2024-02-25更新
|
68次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高一下学期开学考试化学试题
名校
3 . 高铁酸钾( )是一新型、高效、无毒的多功能水处理剂。
)是一新型、高效、无毒的多功能水处理剂。 为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定:
,在碱性溶液中较稳定: 遇KSCN溶液显红色。
遇KSCN溶液显红色。
(1)制备 。
。

①C为制备 装置,KOH溶液过量的原因是
装置,KOH溶液过量的原因是_______ 。
②D为尾气处理装置,发生反应的离子方程式为_______ 。
(2)探究 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明
。为证明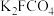 能否氧化
能否氧化 而产生
而产生 ,设计以下方案:
,设计以下方案:
①由方案I中溶液变红可知a中含有_______ ,该离子的产生_______ (填“能”或“不能”)判断一定是由 被
被 还原而形成的。
还原而形成的。
②方案II得出氧化性:
_______  (填“>”或“<”)
(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下,配平及完成上述离子方程式
在硫酸溶液中反应如下,配平及完成上述离子方程式_______ 。

现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.96g气体。则样品中高铁酸钾的质量分数约为_______ 。(计算结果保留到0.1%)
 )是一新型、高效、无毒的多功能水处理剂。
)是一新型、高效、无毒的多功能水处理剂。 为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定:
,在碱性溶液中较稳定: 遇KSCN溶液显红色。
遇KSCN溶液显红色。(1)制备
 。
。
①C为制备
 装置,KOH溶液过量的原因是
装置,KOH溶液过量的原因是②D为尾气处理装置,发生反应的离子方程式为
(2)探究
 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明
。为证明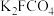 能否氧化
能否氧化 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b.取少量b,滴加盐酸,有 溶出,得到紫色溶液b.取少量b,滴加盐酸,有 产生。 产生。 |
 被
被 还原而形成的。
还原而形成的。②方案II得出氧化性:

 (填“>”或“<”)
(填“>”或“<”)(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下,配平及完成上述离子方程式
在硫酸溶液中反应如下,配平及完成上述离子方程式
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.96g气体。则样品中高铁酸钾的质量分数约为
您最近一年使用:0次
4 . 下列说法正确的是
①化合物主要包括:酸、碱、盐和氧化物;
②按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体;
③溶液呈电中性,胶体带有电荷;
④制备 胶体,可向沸水中滴加
胶体,可向沸水中滴加 饱和溶液并长时间煮沸;
饱和溶液并长时间煮沸;
⑤氢氧化铁、有色玻璃和果冻都是胶体;
⑥向饱和 溶液中加入少量无水CaO固体,恢复原温度,溶液中
溶液中加入少量无水CaO固体,恢复原温度,溶液中 的质量分数不变;
的质量分数不变;
⑦醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物;
⑧酸性氯化物不一定是非金属氧化物,碱性氧化物一定是金属氧化物
①化合物主要包括:酸、碱、盐和氧化物;
②按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体;
③溶液呈电中性,胶体带有电荷;
④制备
 胶体,可向沸水中滴加
胶体,可向沸水中滴加 饱和溶液并长时间煮沸;
饱和溶液并长时间煮沸;⑤氢氧化铁、有色玻璃和果冻都是胶体;
⑥向饱和
 溶液中加入少量无水CaO固体,恢复原温度,溶液中
溶液中加入少量无水CaO固体,恢复原温度,溶液中 的质量分数不变;
的质量分数不变;⑦醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物;
⑧酸性氯化物不一定是非金属氧化物,碱性氧化物一定是金属氧化物
| A.②⑥⑧ | B.①②④⑥ | C.①②④⑦ | D.②⑤⑧ |
您最近一年使用:0次
2022-12-12更新
|
277次组卷
|
3卷引用:湖北省武汉市第六中学2022-2023学年高一上学期9月入学第一次测试化学试题
湖北省武汉市第六中学2022-2023学年高一上学期9月入学第一次测试化学试题(已下线)云南师范大学附属中学2023-2024学年高一上学期开学考试化学试题云南师范大学附属中学2023-2024学年高一上学期开学考试化学试题
名校
解题方法
5 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
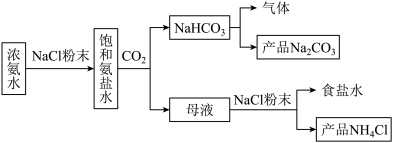
回答下列问题:
(1)侯氏制碱的主要产品是Na2CO3,其俗名是_______ 。
(2)生成NaHCO3的总反应的化学方程式为_______ 。
(3)从下图A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是_______ (按气流方向,用小写字母表示),A中仪器M的名称为_______ ,B中使用雾化装置的优点是_______ 。
A.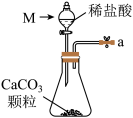 B.
B.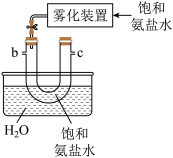 C.
C.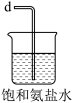
D.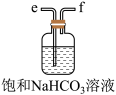 E.
E.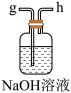
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①灼烧NaHCO3,发生反应为:2NaHCO3 Na2CO3+H2O↑+CO2↑。
Na2CO3+H2O↑+CO2↑。
若灼烧前后固体质量减少1.24g,则生成的Na2CO3的质量为_______ g。
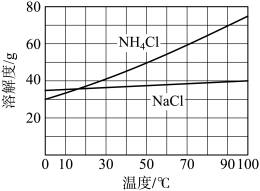
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为蒸发浓缩、_______ 、过滤、洗涤、干燥。
(5)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究一:确定纯碱样品中是否含有NaCl
有同学认为该实验方案有错误,正确方案应选用_______ (填字母)代替稀盐酸。
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
探究二:测定纯碱样品中Na2CO3的质量分数
【方案1】称取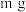 样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为
样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为_______ 。
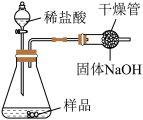
【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算Na2CO3的质量分数。若结果大于100%,可能的原因是_______ 。

回答下列问题:
(1)侯氏制碱的主要产品是Na2CO3,其俗名是
(2)生成NaHCO3的总反应的化学方程式为
(3)从下图A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是
A.
 B.
B. C.
C.
D.
 E.
E.
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①灼烧NaHCO3,发生反应为:2NaHCO3
 Na2CO3+H2O↑+CO2↑。
Na2CO3+H2O↑+CO2↑。若灼烧前后固体质量减少1.24g,则生成的Na2CO3的质量为
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为蒸发浓缩、

(5)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究一:确定纯碱样品中是否含有NaCl
| 实验操作 | 现象 | 结论 |
| 取样品加水溶解,加入过量稀盐酸至反应完全 | 有气泡产生 | 样品中有NaCl |
| 向上述溶液中继续滴加适量AgNO3溶液 | 有 |
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
探究二:测定纯碱样品中Na2CO3的质量分数
【方案1】称取
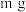 样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为
样品溶解,加入过量CaCl2溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中Na2CO3的质量分数为【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算Na2CO3的质量分数。若结果大于100%,可能的原因是

您最近一年使用:0次
解题方法
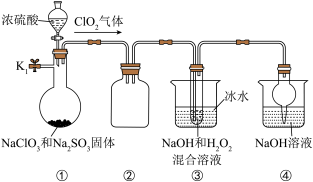
6 . NaClO2是一种高效的杀菌消毒剂,也常用来漂白织物。制备NaClO2的装置如图所示:
回答下列问题:
(1)仪器组装完毕后必须进行的实验操作是_______ 。
(2)装置②的作用是_______ 。
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为_______ 。
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,_______ 。
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、_______ 、过滤洗涤、干燥等。
(6)晶体以NaClO2•3H2O的形式存在,已知: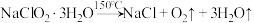 。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是
。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是_______ 。若发生副反应 ,则实验测得的值会
,则实验测得的值会_______ (填“偏大”“偏小”或“不变”)。

回答下列问题:
(1)仪器组装完毕后必须进行的实验操作是
(2)装置②的作用是
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、
(6)晶体以NaClO2•3H2O的形式存在,已知:
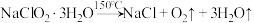 。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是
。为测定所得固体中NaClO2•3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为ag,灼烧恒重后,得到固体bg。则晶体中NaClO2•3H2O的质量分数是 ,则实验测得的值会
,则实验测得的值会
您最近一年使用:0次
解题方法
7 . 二氧化氯(ClO2)是一种高效消毒灭菌剂,可有效灭活新冠病毒,但其稳定性较差,故常采用H2O2和NaOH混合溶液将其吸收转化为NaClO2保存。现利用如下装置及试剂制备NaClO2。
已知:①ClO2的熔点为−59℃,沸点为11℃,纯的或浓度较大的ClO2易分解爆炸;ClO2极易溶于水。
②饱和NaClO2溶液中析出晶体成分与温度的关系如下表所示:
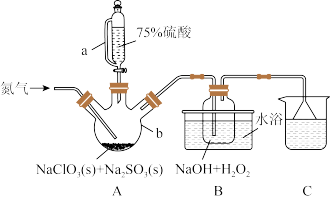
回答下列问题:
(1)仪器b的名称为___________ 使用a添加液体的优点___________ 。
(2)装置B水浴方式为___________ (填“冰水浴”或“80℃水浴”);其中生成NaClO2的离子方程式为___________ 。
(3)实验过程中持续通入N2的速度不能太慢也不能太快的原因是___________
(4)从NaClO2溶液中获得NaClO2固体的操作:
①减压,55℃蒸发结晶;②___________ ;③无水乙醇洗涤;④___________ ,得到成品。
(5)NaClO2,纯度的测定:称取ag产品配成250mL溶液,取25.00mL溶液,加入足量的KI溶液和稀硫酸(4H++ +4I-=2I2+Cl-+2H2O),充分反应后加入指示剂,用b mol∙L−1Na2S2O3标准溶液滴定至终点(I2+2
+4I-=2I2+Cl-+2H2O),充分反应后加入指示剂,用b mol∙L−1Na2S2O3标准溶液滴定至终点(I2+2 =2I-+
=2I-+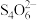 ),平均消耗标准溶液的体积为VmL,则产品中NaClO2,的质量分数是
),平均消耗标准溶液的体积为VmL,则产品中NaClO2,的质量分数是__________ (用含a、b、v的代数式表示)
已知:①ClO2的熔点为−59℃,沸点为11℃,纯的或浓度较大的ClO2易分解爆炸;ClO2极易溶于水。
②饱和NaClO2溶液中析出晶体成分与温度的关系如下表所示:
| 温度/℃ | <38 | 38~60 | >60 |
| 晶体成分 | NaClO2·3H2O | NaClO2 | NaClO2分解成NaClO3和NaCl |

回答下列问题:
(1)仪器b的名称为
(2)装置B水浴方式为
(3)实验过程中持续通入N2的速度不能太慢也不能太快的原因是
(4)从NaClO2溶液中获得NaClO2固体的操作:
①减压,55℃蒸发结晶;②
(5)NaClO2,纯度的测定:称取ag产品配成250mL溶液,取25.00mL溶液,加入足量的KI溶液和稀硫酸(4H++
 +4I-=2I2+Cl-+2H2O),充分反应后加入指示剂,用b mol∙L−1Na2S2O3标准溶液滴定至终点(I2+2
+4I-=2I2+Cl-+2H2O),充分反应后加入指示剂,用b mol∙L−1Na2S2O3标准溶液滴定至终点(I2+2 =2I-+
=2I-+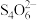 ),平均消耗标准溶液的体积为VmL,则产品中NaClO2,的质量分数是
),平均消耗标准溶液的体积为VmL,则产品中NaClO2,的质量分数是
您最近一年使用:0次
2022-09-09更新
|
627次组卷
|
4卷引用:湖北省“宜荆荆恩”2023届高三上学期起点考试化学试题
湖北省“宜荆荆恩”2023届高三上学期起点考试化学试题湖北省2023届高三上学期9月起点考试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)2022年辽宁高考真题化学试题变式题(实验综合题)
8 . NA代表阿伏加德罗常数的值。下列说法正确的是
| A.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA |
| B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA |
| C.56gFe高温下与足量水蒸气反应转移电子数为3NA |
| D.常温常压下,100g质量分数为46%的乙醇水溶液中含有的氧原子数为NA |
您最近一年使用:0次
名校
9 . 据古籍记载,焙烧绿矾( )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。

回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量___________ (填写试剂名称),振荡,溶液变为红色。由此可知该样品___________ (填“已”或“未”)变质。
(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式___________ 。
(3)装置 中冷水的作用是
中冷水的作用是___________ 。
(4)为防止倒吸,停止实验时应进行的操作是___________ 。
(5)用 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取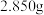 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用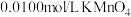 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。
①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、___________ 。
②该实验滴定终点时溶液的颜色变为___________ 。
③该绿矾样品中 的质量分数为
的质量分数为___________ (计算结果保留3位有效数字)。
 )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加
 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式
(3)装置
 中冷水的作用是
中冷水的作用是(4)为防止倒吸,停止实验时应进行的操作是
(5)用
 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取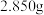 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用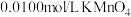 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、
②该实验滴定终点时溶液的颜色变为
③该绿矾样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2021-04-24更新
|
548次组卷
|
5卷引用:湖北省武汉市2020-2021学年高三下学期4月质量检测化学试题
解题方法
10 . 元素A、B、C、D、E、F都是元素周期表中前20号元素, 其中A、B、C、D、E的原子序数依次增大,它们的原子半径和最外层电子数之间的关系如图所示,F是地壳中含量最高的金属元素。试回答:

(1)A元素在周期表中位置为:_____________ 。D的原子结构示意图为:_____________ 。
(2) A、C、D三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是(用对应化学式回答):______ 。
(3)用电子式表示E2C的形成过程:_______________ 。
(4)写出单质F与B元素最高价氧化物对应的水化物反应的离子方程式:______________ 。
(5)已知X是元素C同族的短周期元素:
①X与氢原子能形成种强氧化性分子 H2X2,则该分子的结构式为:______________ 。
②试比较X元素的最简单氢化物与C元素的最简单氢化物的沸点:_______ >______ (用对应化学式回答),原因是:___________________ 。

(1)A元素在周期表中位置为:
(2) A、C、D三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是(用对应化学式回答):
(3)用电子式表示E2C的形成过程:
(4)写出单质F与B元素最高价氧化物对应的水化物反应的离子方程式:
(5)已知X是元素C同族的短周期元素:
①X与氢原子能形成种强氧化性分子 H2X2,则该分子的结构式为:
②试比较X元素的最简单氢化物与C元素的最简单氢化物的沸点:
您最近一年使用:0次



