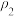名校
解题方法
1 . NaCl是一种化工原料,可以制备多种物质,如图所示。
请回答下列问题:
(1)图所列物质中属于电解质的有_____ 种,转化反应中属于氧化还原反应的有_____ (填图中序号)
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是_____________ 。
(3)反应④的现象是_____ ;反应⑤的化学方程式为_____ 。
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1 g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。
该同学从中取出100 mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=_____ mol/L(结果保留两位小数);“84消毒液”不能与“洁厕灵(主要成分是HCl)”混合使用,否则会产生黄绿色的有毒气体引起安全事故,其反应的离子方程式是_________ 。
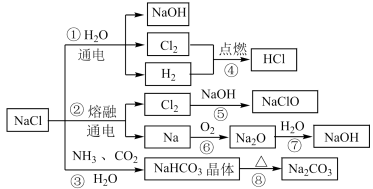
(5)反应③和⑧是工业制备纯碱的原理,我国化学工业科学家侯德榜提出了将氨碱法(又称索尔维法)制取碳酸钠和合成氨联合的改进工艺,这就是联合制碱法,也称侯氏制碱法。侯氏制碱法提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,将制碱技术发展到了一个新的水平,赢得了国际化工界的高度评价。以下是这两种制碱法的工艺流程图:
下列说法正确的是_____ (填序号)。
A.用NaCl制取纯碱的过程中,利用了物质溶解度的差异
B.沉淀池中NH3与CO2的通入顺序为先通入CO2,再通入NH3
C.索尔维制碱法所得“排出液”的主要成分为CaCl2
D.侯氏制碱法循环利用的物质主要是CO2和NH3
E.侯氏制碱法从母液中经过循环Ⅱ进入沉淀池的主要有NH3·H2O、NH4Cl、Na2CO3,从而使原料NaCl的利用率大大提升
F.侯氏制碱法在母液中加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
G.检验产品Na2CO3中是否含有NaCl的操作方法是取少量试样溶于水,加入过量的稀硝酸,再滴加硝酸银溶液,观察是否有白色沉淀生成

请回答下列问题:
(1)图所列物质中属于电解质的有
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是
(3)反应④的现象是
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1 g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。
该同学从中取出100 mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=
(5)反应③和⑧是工业制备纯碱的原理,我国化学工业科学家侯德榜提出了将氨碱法(又称索尔维法)制取碳酸钠和合成氨联合的改进工艺,这就是联合制碱法,也称侯氏制碱法。侯氏制碱法提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,将制碱技术发展到了一个新的水平,赢得了国际化工界的高度评价。以下是这两种制碱法的工艺流程图:

下列说法正确的是
A.用NaCl制取纯碱的过程中,利用了物质溶解度的差异
B.沉淀池中NH3与CO2的通入顺序为先通入CO2,再通入NH3
C.索尔维制碱法所得“排出液”的主要成分为CaCl2
D.侯氏制碱法循环利用的物质主要是CO2和NH3
E.侯氏制碱法从母液中经过循环Ⅱ进入沉淀池的主要有NH3·H2O、NH4Cl、Na2CO3,从而使原料NaCl的利用率大大提升
F.侯氏制碱法在母液中加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
G.检验产品Na2CO3中是否含有NaCl的操作方法是取少量试样溶于水,加入过量的稀硝酸,再滴加硝酸银溶液,观察是否有白色沉淀生成
您最近一年使用:0次
2020-11-24更新
|
258次组卷
|
2卷引用:青海省湟川中学2020-2021学年高一下学期开学考试化学试题
23-24高一上·全国·期中
名校
解题方法
2 . 钠的化合物在日常生活中的应用非常广泛。回答下列问题:
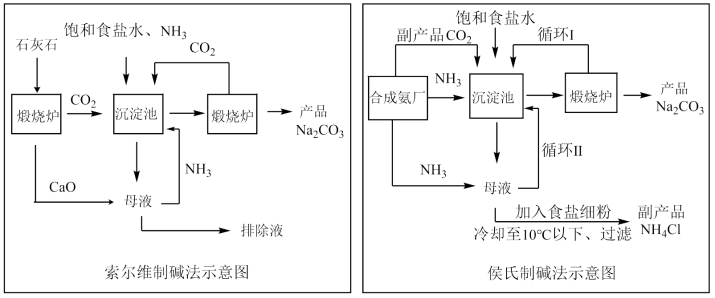
Ⅰ.为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。
(1)实验前首先要进行的操作是___________ 。
(2)某同学称取65.4 g混合物于锥形瓶中,打开止水夹,通入N2,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间N2。停止通N2,装置C的质量增加30.8 g。
①两次通入N2的目的分别是___________ 、___________ 。
②混合物中Na2CO3的物质的量为___________ mol。
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
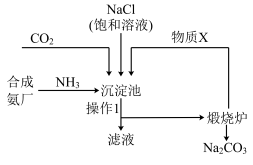
资料:沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(3)操作1的名称为___________ ;煅烧炉中反应的化学方程式为___________ 。
(4)物质X可循环利用,其化学式为___________ 。
(5)某同学提出制得的纯碱中可能含有氯化钠,请设计实验鉴别:___________ (写出步骤、现象和结论)。
Ⅰ.为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。
(1)实验前首先要进行的操作是
(2)某同学称取65.4 g混合物于锥形瓶中,打开止水夹,通入N2,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间N2。停止通N2,装置C的质量增加30.8 g。

①两次通入N2的目的分别是
②混合物中Na2CO3的物质的量为
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。

资料:沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(3)操作1的名称为
(4)物质X可循环利用,其化学式为
(5)某同学提出制得的纯碱中可能含有氯化钠,请设计实验鉴别:
您最近一年使用:0次
名校
3 . 用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.NA个氢氧化铁胶体粒子的质量为107g |
| B.0.1mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA |
| C.100g质量分数为17%的H2O2水溶液中含氧原子数目为NA |
| D.2.7g铝与足量的稀硫酸和氢氧化钠分别反应,得到氢气的体积在标准状况下均为3.36L |
您最近一年使用:0次
2021-03-19更新
|
64次组卷
|
3卷引用:青海省湟川中学2020-2021学年高一下学期开学考试化学试题
名校
4 . 已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

(1)表中硫酸的质量分数为____ (不写单位,用含c1、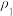 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为___ mol·L-1。
(3)将物质的量浓度分别为c2mol·L-1和0.2c2mol·L-1的氨水等质量混合,所得溶液的物质的量浓度___ 0.6c2mol·L-1(填“大于”“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。

溶质的物质的量浓度/(mol∙L-1) | 溶液的密度/(g∙cm-3) | |
硫酸 | c1 |
|
氨水 | c2 |
|
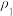 的代数式表示)。
的代数式表示)。(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为
(3)将物质的量浓度分别为c2mol·L-1和0.2c2mol·L-1的氨水等质量混合,所得溶液的物质的量浓度
您最近一年使用:0次
名校
解题方法
5 . A~G为中学常见的物质,其中A~F中含有同一种金属元素,各物质间有如下转化关系。其中B、G为地壳中含量排前两位的金属单质,D、F为碱,C、E为仅含两种元素的盐(部分条件已省略)。
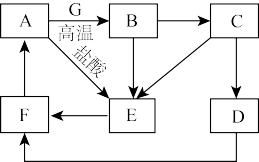
回答下列问题:
(1)A的化学式为___________ ;E溶液的颜色为___________ 色。
(2)E转化为F的离子方程式为___________ 。
(3)在溶液中D转化为F的现象为___________ 。
(4)某同学在老师的指导下展开了延伸学习,配制480mL C溶液。
C溶液。
①在配制C溶液时需加入少量铁屑,其目的是___________ 。
②在配制过程中,下列错误操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:___________ ;
b、烧杯和玻璃棒未洗涤:___________ ;
c、定容时俯视刻度线:___________ 。

回答下列问题:
(1)A的化学式为
(2)E转化为F的离子方程式为
(3)在溶液中D转化为F的现象为
(4)某同学在老师的指导下展开了延伸学习,配制480mL
 C溶液。
C溶液。①在配制C溶液时需加入少量铁屑,其目的是
②在配制过程中,下列错误操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:
b、烧杯和玻璃棒未洗涤:
c、定容时俯视刻度线:
您最近一年使用:0次
2023-01-07更新
|
198次组卷
|
4卷引用:青海省西宁市大通回族土族自治县第二完全中学2022-2023学年高一下学期开学检测化学试卷
名校
解题方法
6 . 在t℃时,将agNH3完全溶于水,得到VmL溶液,设该溶液的密度为ρg•cm-3,质量分数为ω,其中含NH4+的物质的量为bmol。下列叙述中不正确的是
A.溶质的质量分数为ω=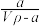 ×100% ×100% |
B.溶质的物质的量浓度c=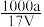 mol•L-1 mol•L-1 |
C.溶液中c(OH-)=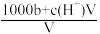 mol/L mol/L |
| D.上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5ω |
您最近一年使用:0次
2020-03-03更新
|
274次组卷
|
6卷引用:青海省湟川中学2020-2021学年高一下学期开学考试化学试题
名校
7 . 下列实验操作会导致实验结果偏低的是
①配制100g10%的CuSO4溶液,称取10g硫酸铜晶体溶于90g水中②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮③向80mL水中加入18.4mol/L硫酸20mL,配制3.68mol/L的硫酸溶液④配制一定物质的量浓度的硫酸溶液,定容时俯视
①配制100g10%的CuSO4溶液,称取10g硫酸铜晶体溶于90g水中②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮③向80mL水中加入18.4mol/L硫酸20mL,配制3.68mol/L的硫酸溶液④配制一定物质的量浓度的硫酸溶液,定容时俯视
| A.只有① | B.只有② | C.②③④ | D.①③④ |
您最近一年使用:0次