名校
1 . 化学科学可以帮助我们安全、合理、有效地开发自然资源和使用各种化学品,为建设美丽家园发挥重要价值。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:
(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是_______ 法。
(2)步骤Ⅰ中已获得 Br2,步骤Ⅱ中又将 Br2还原为 Br-,其目的是_______ 。
(3)步骤Ⅱ用 SO2溶液吸收 Br2,反应的离子方程式为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。
②2NO2 + Na2O2 = 2NaNO3
③酸性条件下,NO、NO2和 NO 都能与 MnO
都能与 MnO 反应生成 NO
反应生成 NO 和 Mn2+
和 Mn2+
请回答下列问题:
(4)装置 A 中发生反应的化学方程式为_______ 。
(5)装置 C 的作用为_______ ,装置 E 的作用为_______ 。
(6)装置 F 中发生反应的离子方程式为_______ 。
(7)为测定亚硝酸钠的含量,进行如下操作:称取 3.000 g 样品溶于水配成 250 mL 溶液,取 25.00 mL溶液于锥形瓶中,再向锥形瓶中加入 0.1000mol·L-1酸性 KMnO4溶液 16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为_______ (保留四位有效数字)。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:

(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是
(2)步骤Ⅰ中已获得 Br2,步骤Ⅱ中又将 Br2还原为 Br-,其目的是
(3)步骤Ⅱ用 SO2溶液吸收 Br2,反应的离子方程式为
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。

②2NO2 + Na2O2 = 2NaNO3
③酸性条件下,NO、NO2和 NO
 都能与 MnO
都能与 MnO 反应生成 NO
反应生成 NO 和 Mn2+
和 Mn2+请回答下列问题:
(4)装置 A 中发生反应的化学方程式为
(5)装置 C 的作用为
(6)装置 F 中发生反应的离子方程式为
(7)为测定亚硝酸钠的含量,进行如下操作:称取 3.000 g 样品溶于水配成 250 mL 溶液,取 25.00 mL溶液于锥形瓶中,再向锥形瓶中加入 0.1000mol·L-1酸性 KMnO4溶液 16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为
您最近一年使用:0次
2 . 过氧化钙(CaO2)是一种微溶于水的白色固体,广泛用千水产养殖、污水处理等方面。
(1)实验室可用如图装置制备过氧化钙。

按气流方向从左到右,各仪器接口的连接顺序为_______ (填字母编号)。装置Ⅲ中的试剂为_______ ,其作用是_______ 。
(2)上述实验制得的CaO2样品中会混有少量氧化钙。用如图装置测定CaO2的含量。

①CaO2与稀盐酸反应的化学方程式为_______ 。
②若称取CaO2样品的质量是1.0g,测得生成气体的体积为112mL(已换算成标准状况),则样品中CaO2的质量分数为_______ 。
(3)一种工业制备过氧化钙的过程如下:
Ca(OH)2悬浊液
 CaO2·8H2O晶体
CaO2·8H2O晶体
步骤I中反应的化学方程式为_______ 。该反应需在冰水浴中进行,原因是_______ 。
(4)CaO2与水反应缓慢,在水产养殖及运输中广泛用作释氧剂,增加水中溶解氧。解释CaO2与水反应较Na2O2缓慢的原因:_______ 。
(1)实验室可用如图装置制备过氧化钙。

按气流方向从左到右,各仪器接口的连接顺序为
(2)上述实验制得的CaO2样品中会混有少量氧化钙。用如图装置测定CaO2的含量。

①CaO2与稀盐酸反应的化学方程式为
②若称取CaO2样品的质量是1.0g,测得生成气体的体积为112mL(已换算成标准状况),则样品中CaO2的质量分数为
(3)一种工业制备过氧化钙的过程如下:
Ca(OH)2悬浊液

 CaO2·8H2O晶体
CaO2·8H2O晶体
步骤I中反应的化学方程式为
(4)CaO2与水反应缓慢,在水产养殖及运输中广泛用作释氧剂,增加水中溶解氧。解释CaO2与水反应较Na2O2缓慢的原因:
您最近一年使用:0次
3 . 化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_______ 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________ 。
II.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________ 。
(4)D装置的作用是_________ 。
(5)C中反应的离子方程式是____________ 。
(6)下列各项措施中,不能提高测定准确度的是________ (填标号)。
①在加入盐酸之前,应排净装置内的CO2气体②滴加盐酸不宜过快③在A-B之间增添盛有浓H2SO4的洗气装置④在B-C之间增添盛有饱和NaHCO3溶液的洗气装置
(7)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为___ 。
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
II.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)D装置的作用是
(5)C中反应的离子方程式是
(6)下列各项措施中,不能提高测定准确度的是
①在加入盐酸之前,应排净装置内的CO2气体②滴加盐酸不宜过快③在A-B之间增添盛有浓H2SO4的洗气装置④在B-C之间增添盛有饱和NaHCO3溶液的洗气装置
(7)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为
您最近一年使用:0次
4 . 实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84”消毒液,已知酸性: 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是A.将次氯酸钠质量分数为12.6%的该消毒液 ,加水稀释为5%的溶液,需加水 ,加水稀释为5%的溶液,需加水 |
B.空气中喷洒“84”消毒液可以达到对环境消毒的目的,其消毒原理为: |
| C.用pH试纸无法测出“84消毒液”的pH |
| D.“84”消毒液与洁厕灵(主要成分为盐酸)不能混用 |
您最近一年使用:0次
2024-01-30更新
|
78次组卷
|
3卷引用:辽宁省本溪市第一中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
5 . 下列说法不正确的是
| A.某硝酸密度为1.42g•cm-3,质量分数为63%,此硝酸物质的量浓度为14.2mol//L |
| B.将100g浓度为1.0mol/L的硫酸与一定体积的水混合稀释成0.5mol/L,则水的体积大于100mL |
| C.当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1mol•L-1,或有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1mol•L-1 |
D.VLAl2(SO4)3溶液中含Al3+ag,则溶液中的 物质的量浓度为 物质的量浓度为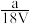 mol/L mol/L |
您最近一年使用:0次
2023-09-17更新
|
122次组卷
|
2卷引用:辽宁省实验中学2023-2024学年高三上学期期初考试化学试题
6 . X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4。
回答下列问题:
(1)用电子式表示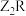 的形成过程:
的形成过程:__________ 。
(2)W在周期表中的位置是__________ 。
(3)ZYX的电子式为__________ ,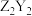 中含有的化学键类型为
中含有的化学键类型为__________ 。
(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是__________ (用元素的离子符号表示)。
(5)下列说法能证明非金属性Q强于R的是__________ (填字母)。
a.简单阴离子的还原性: b.简单氢化物热稳定性:
b.简单氢化物热稳定性:
c.氧化物对应的水化物的酸性: d.Q的单质能从
d.Q的单质能从 溶液中置换出R单质
溶液中置换出R单质
(6)35号元素溴 和Q位于同一主族,被称为“海洋元素”,高溴酸
和Q位于同一主族,被称为“海洋元素”,高溴酸 的酸性比
的酸性比
__________ (填“强”或“弱”),请从位—构—性角度 分析原因_____________ 。
回答下列问题:
(1)用电子式表示
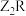 的形成过程:
的形成过程:(2)W在周期表中的位置是
(3)ZYX的电子式为
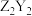 中含有的化学键类型为
中含有的化学键类型为(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(5)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:
 b.简单氢化物热稳定性:
b.简单氢化物热稳定性:
c.氧化物对应的水化物的酸性:
 d.Q的单质能从
d.Q的单质能从 溶液中置换出R单质
溶液中置换出R单质(6)35号元素溴
 和Q位于同一主族,被称为“海洋元素”,高溴酸
和Q位于同一主族,被称为“海洋元素”,高溴酸 的酸性比
的酸性比
您最近一年使用:0次
解题方法
7 . 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁。实验室中利用下图所示装置探究由废铁屑制备 晶体的原理并测定铁屑中铁单质的质量分数。
晶体的原理并测定铁屑中铁单质的质量分数。

已知:①废铁屑中杂质不溶于水且不与酸反应;
② 对
对 分解有催化作用。
分解有催化作用。
(1)仪器A与装置B连接的橡胶管的作用是_______ 。
(2)如下:
①关闭_______ ,打开弹簧夹K;
②向水准管中加水,使水准管液面高于量气管液面;
③观察到_______ 说明气密性良好。
取mg废铁屑加入B装置中,在A中加入足量的盐酸后进行下列操作:
Ⅰ.打开弹簧夹K,关闭活塞b,打开活塞a,缓慢滴加盐酸。
Ⅱ.当装置D的量气管一侧液面不再下降时,关闭弹簧夹K,打开活塞b,当A、B中溶液完全进入烧杯后关闭活塞a、b。
Ⅲ.将烧杯中的溶液经过一系列操作后得到 晶体。
晶体。
请回答:
(3)用离子方程式表示烧杯中足量的 溶液的作用:
溶液的作用:_______ 。如果在A中加入的盐酸不足,会发现烧杯中出现大量气泡,用化学方程式解释其原因_______ 。
 晶体的原理并测定铁屑中铁单质的质量分数。
晶体的原理并测定铁屑中铁单质的质量分数。
已知:①废铁屑中杂质不溶于水且不与酸反应;
②
 对
对 分解有催化作用。
分解有催化作用。(1)仪器A与装置B连接的橡胶管的作用是
(2)如下:
①关闭
②向水准管中加水,使水准管液面高于量气管液面;
③观察到
取mg废铁屑加入B装置中,在A中加入足量的盐酸后进行下列操作:
Ⅰ.打开弹簧夹K,关闭活塞b,打开活塞a,缓慢滴加盐酸。
Ⅱ.当装置D的量气管一侧液面不再下降时,关闭弹簧夹K,打开活塞b,当A、B中溶液完全进入烧杯后关闭活塞a、b。
Ⅲ.将烧杯中的溶液经过一系列操作后得到
 晶体。
晶体。请回答:
(3)用离子方程式表示烧杯中足量的
 溶液的作用:
溶液的作用:
您最近一年使用:0次
解题方法
8 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸、氢氧化钠溶液反应)
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水
②配制0.50mol/L的稀盐酸和0.50mol/L的NaOH溶液
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积
④加入25.00mL、0.50mol/L的稀盐酸
请回答下列问题:
(1)正确的操作顺序是_________ (填序号)
(2)测定过程中发生反应的离子方程式为_________
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
①按所需用量配制上述0.50mol/L的稀盐酸时,需要选取_________ 的容量瓶。(填字母)
a.50mL b.100mL c.250mL
除容量瓶之外,还需要的主要仪器有量筒、烧杯、_________
②用浓盐酸配制稀盐酸的过程中,下列操作对所配制的盐酸浓度造成的影响分别是什么?(填“偏大”、 “偏小”或“不变”)
容量瓶不干燥_________
用量筒量取浓盐酸时仰视读数_________
未洗涤烧杯_________
③根据上边的实验数据,计算这种药片中碳酸钙的质量分数为_________
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水
②配制0.50mol/L的稀盐酸和0.50mol/L的NaOH溶液
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积
④加入25.00mL、0.50mol/L的稀盐酸
请回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.02 | 13.12 | 12.98 | 13.00 |
a.50mL b.100mL c.250mL
除容量瓶之外,还需要的主要仪器有量筒、烧杯、
②用浓盐酸配制稀盐酸的过程中,下列操作对所配制的盐酸浓度造成的影响分别是什么?(填“偏大”、 “偏小”或“不变”)
容量瓶不干燥
用量筒量取浓盐酸时仰视读数
未洗涤烧杯
③根据上边的实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 三氯化铁是棕黄色、易潮解、100℃能升华的物质,工业上常用FeCl3作印刷电路板的蚀刻剂。某化学学习小组在实验室用氯气与金属铁反应制备无水三氯化铁,其实验装置如下。

(1)FeCl3溶液蚀刻印刷铜电路板的离子方程式为_______ 。
(2)装置A中三颈烧瓶里反应的化学方程式是_______ 。
(3)实验开始前先通氮气的目的是_______ 。
(4)为使氯气与铁充分反应,应注意的操作是_______ (回答2点)。
(5)请你评价该装置的主要缺点是_______ 。
(6)请你帮助学习小组同学设计实验证明反应产物中一定含有Fe3+:_______ (要求有试剂、现象和操作)。
(7)测定FeCl3产品的纯度:取wg FeCl3产品配制成250mL溶液,取25.00 mL配制的溶液于锥形瓶中,加入V mL c mol/L AgNO3溶液恰好完全反应。则该FeCl3产品的纯度(质量分数)为_______ %(用含w、c和V的代数式表示)。

(1)FeCl3溶液蚀刻印刷铜电路板的离子方程式为
(2)装置A中三颈烧瓶里反应的化学方程式是
(3)实验开始前先通氮气的目的是
(4)为使氯气与铁充分反应,应注意的操作是
(5)请你评价该装置的主要缺点是
(6)请你帮助学习小组同学设计实验证明反应产物中一定含有Fe3+:
(7)测定FeCl3产品的纯度:取wg FeCl3产品配制成250mL溶液,取25.00 mL配制的溶液于锥形瓶中,加入V mL c mol/L AgNO3溶液恰好完全反应。则该FeCl3产品的纯度(质量分数)为
您最近一年使用:0次
名校
10 . 下列实验方法能达到实验目的的是
| 选项 | 实验目的 | 实验方法 |
| A | 配制质量分数为5%的KNO3溶液 | 向盛有5.0gKNO3固体的烧杯中,加入100g水,搅拌 |
| B | 验证Al、Cu、Ag的金属活动性顺序 | 向CuSO4溶液和AgNO3溶液中各放入大小、形状相同的Al丝 |
| C | 鉴别CuSO4、BaSO4和CaCO3三种白色固体 | 分别取少量固体样品,加适量水,搅拌 |
| D | 检验氢气的纯度 | 用拇指堵住集满氢气的试管口,管口向下靠近火焰,移开拇指点火 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-03更新
|
128次组卷
|
3卷引用:辽宁省沈阳市同泽高级中学2022-2023学年高一上学期期初考试化学试题



