解题方法
1 . 人胃酸(主要成分是盐酸)过多,会引起很多胃病。下图为某抗酸药包装标签上的部分文字,请回答下列问题。

(1)该药“嚼碎后吞服”的原因是_____________________。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0mL。通过计算:
①判断该药片中氢氧化铝的含量是否与标签相符;
②确定该药片中氢氧化铝的质量分数为多少。

(1)该药“嚼碎后吞服”的原因是_____________________。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0mL。通过计算:
①判断该药片中氢氧化铝的含量是否与标签相符;
②确定该药片中氢氧化铝的质量分数为多少。
您最近一年使用:0次
2 . 食盐和纯碱都是重要的化工原料,位于内蒙古中南部的达来诺尔湖中含有丰富的食盐和纯碱。夏天,将湖水引入湖滩上晒出食盐;冬天,湖面上会漂浮着大量的纯碱晶体(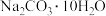 ),可以直接从湖中捞碱。
),可以直接从湖中捞碱。
Ⅰ.化学原理分析
(1)冬天“捞碱”的化学原理属于降温结晶,夏天“晒盐”的化学原理属于________ 。
(2)“捞碱”所得纯碱晶体中往往混有 ,检验
,检验 是否存在时,使用的试剂是
是否存在时,使用的试剂是________ (填化学式)。
Ⅱ.纯碱样品(含 杂质)中
杂质)中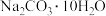 质量分数的测定
质量分数的测定
第一步:称取质量为w g的样品,置于广口瓶中。
第二步:量取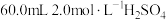 溶液于分液漏斗中,与样品完全反应生成二氧化碳。
溶液于分液漏斗中,与样品完全反应生成二氧化碳。 溶液需用质量分数为98%、密度为
溶液需用质量分数为98%、密度为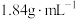 的浓硫酸进行配制。
的浓硫酸进行配制。
(3)通过计算,需量取浓硫酸的体积为________ mL。下图中已列出实验过程需使用的部分仪器,还缺少的实验仪器有________ (填名称)。

(4)某同学配制溶液的过程如下:
①在烧杯中稀释浓硫酸,待溶液冷却至室温后,转移至容量瓶中
②……
③将蒸馏水缓慢注入容量瓶,直到液面接近刻度线1~2cm处
④……
⑤将容量瓶盖好,颠倒摇匀,装入试剂瓶
步骤④的操作为_____________________
(5)若该同学所配的硫酸浓度偏低,可能的原因是______ (填标号)。
a.移液前容量瓶中有少量水
b.洗涤量筒,并将洗涤液转移至容量瓶中
c.定容时俯视液面
d.摇匀后发现液面低于刻度线,补加少量水
第三步:按图示装置进行实验。

(6)经实验测得A装置质量变化量为a g,则样品中纯碱晶体(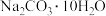 )的质量分数为
)的质量分数为________ ×100%(用含w、a的代数式表示)。
 ),可以直接从湖中捞碱。
),可以直接从湖中捞碱。Ⅰ.化学原理分析
(1)冬天“捞碱”的化学原理属于降温结晶,夏天“晒盐”的化学原理属于
(2)“捞碱”所得纯碱晶体中往往混有
 ,检验
,检验 是否存在时,使用的试剂是
是否存在时,使用的试剂是Ⅱ.纯碱样品(含
 杂质)中
杂质)中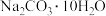 质量分数的测定
质量分数的测定第一步:称取质量为w g的样品,置于广口瓶中。
第二步:量取
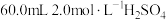 溶液于分液漏斗中,与样品完全反应生成二氧化碳。
溶液于分液漏斗中,与样品完全反应生成二氧化碳。 溶液需用质量分数为98%、密度为
溶液需用质量分数为98%、密度为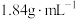 的浓硫酸进行配制。
的浓硫酸进行配制。(3)通过计算,需量取浓硫酸的体积为

(4)某同学配制溶液的过程如下:
①在烧杯中稀释浓硫酸,待溶液冷却至室温后,转移至容量瓶中
②……
③将蒸馏水缓慢注入容量瓶,直到液面接近刻度线1~2cm处
④……
⑤将容量瓶盖好,颠倒摇匀,装入试剂瓶
步骤④的操作为
(5)若该同学所配的硫酸浓度偏低,可能的原因是
a.移液前容量瓶中有少量水
b.洗涤量筒,并将洗涤液转移至容量瓶中
c.定容时俯视液面
d.摇匀后发现液面低于刻度线,补加少量水
第三步:按图示装置进行实验。

(6)经实验测得A装置质量变化量为a g,则样品中纯碱晶体(
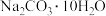 )的质量分数为
)的质量分数为
您最近一年使用:0次
2024-01-29更新
|
71次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
3 . 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用,请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_______ mol/L。(保留两位有效数字)。
(2)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有__________ (写三种)。
(3)某同学取100mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol/L。
(4)配制时,其正确的操作顺序是_________________ (字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓消毒液的体积,倒入烧杯中再慢慢沿杯壁注入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的溶液沿玻璃棒注入一定体积的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(5)“84消毒液”和空气中的某种气体接触,具有强消毒能力,试用化学方程式解释原因:______________ 。
(6)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。


(1)该“84消毒液”的物质的量浓度约为
(2)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有
(3)某同学取100mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=
(4)配制时,其正确的操作顺序是
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓消毒液的体积,倒入烧杯中再慢慢沿杯壁注入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的溶液沿玻璃棒注入一定体积的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(5)“84消毒液”和空气中的某种气体接触,具有强消毒能力,试用化学方程式解释原因:
(6)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。

| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.定容后,摇匀时发现少量液体渐出,对浓度无影响 |
| D.需要称量NaClO固体的质量为149.0g |
您最近一年使用:0次
解题方法
4 . 实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定该瓶样品中氢氧化钠的质量分数,现取17.3g该样品溶于足量的水中(固体完全溶解),向所得溶液中逐滴加入200g一定溶质质量分数的稀盐酸,实验过程如图所示(不考虑碳酸钠的分步反应)。
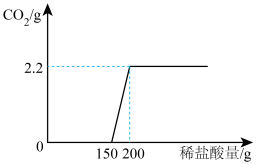
(1)经分析,该氢氧化钠固体_______ (填“部分”或“完全”)变质,恰好完全反应时,产生气体的质量为_______ g。
(2)计算样品中氢氧化钠的质量_______ (写出计算过程)。

(1)经分析,该氢氧化钠固体
(2)计算样品中氢氧化钠的质量
您最近一年使用:0次
名校
5 . “侯氏制碱法”制得的纯碱 中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中
中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中 的质量分数。
的质量分数。

【方案一】沉淀分析法(如图1所示)则:
(1)溶液M中含有的阳离子有___________ 。
(2)确定 溶液是否过量的方法是
溶液是否过量的方法是___________ 。
(3)判断沉淀A洗净的方法是:___________ 。
(4)样品中 的质量分数为
的质量分数为___________ (用字母m、n的代数式表示)。
【方案二】气体分析法(如图2所示)

(5)通过称量___________ 装置在反应前后的质量,即可求得产生二氧化碳的质量。
(6)理论上【方法二】比【方案一】会产生较大的误差,原因是___________ 。
 中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中
中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中 的质量分数。
的质量分数。
【方案一】沉淀分析法(如图1所示)则:
(1)溶液M中含有的阳离子有
(2)确定
 溶液是否过量的方法是
溶液是否过量的方法是(3)判断沉淀A洗净的方法是:
(4)样品中
 的质量分数为
的质量分数为【方案二】气体分析法(如图2所示)

(5)通过称量
(6)理论上【方法二】比【方案一】会产生较大的误差,原因是
您最近一年使用:0次
6 . 中科院成都研究所研究员李东提出了一种新的负排放技术——POWER TO GAS(可再生电转生物天然气)。这项技术,指的是先捕获工厂和沼气池产生的二氧化碳,利用可再生电水解制氢,再将氢气用于还原沼气中的二氧化碳,使二氧化碳变为甲烷( ),替代天然气使用。设
),替代天然气使用。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 ),替代天然气使用。设
),替代天然气使用。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是A.25℃, , ,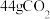 含有 含有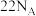 个电子 个电子 |
B. 质量分数为64%的 质量分数为64%的 水溶液中含有的氧原子数目为: 水溶液中含有的氧原子数目为: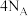 |
C.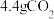 转变为 转变为 转移的电子数为 转移的电子数为 |
D.标准状况下, 中所含有的水分子数目为 中所含有的水分子数目为 |
您最近一年使用:0次
名校
解题方法
7 . 84消毒液广泛应用于杀菌、消毒以及化工领域。
下列观点正确的是
84消毒液 【有效成分】NaClO 【规格】1000mL 【质量分数】25% 【密度】1.19g/cm3 |
| A.NaClO与HClO一样,也易分解 |
B.某84消毒液瓶体部分标签如上图所示,其浓度约为4.0 mol·L |
C.向84消毒液中通入少量 ,离子反应为 ,离子反应为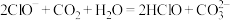 |
| D.84消毒液与洁厕灵混合使用,杀菌消毒能力增强 |
您最近一年使用:0次
名校
8 . 已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______ 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
您最近一年使用:0次
名校
解题方法
9 . 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原料。现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下不同的实验方案:
方案1:铝镁合金与足量盐酸反应,测定气体的质量为m 1g。
方案2:铝镁合金与足量氢氧化钠溶液反应,过滤、洗涤、烘干,测定剩余固体质量w1 g。
方案3:铝镁合金与过量的盐酸反应,在溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧,测定固体的质量w2 g。(说明:Al (OH)3 既可以与酸反应,也可以与碱反应)
(1)某化学实验小组利用如图所示的装置,按照方案1进行了实验。
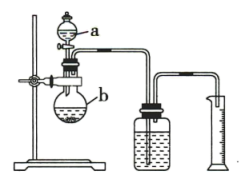
实验装置中有两处明显错误,请指出至少一种:_______ 。
(2)方案2中的化学方程式为_______ 。
(3)方案3中“过滤”操作中用到玻璃棒,玻璃棒的作用是_______ ,若按方案3进行实验,测得的镁的质量分数为_______ 。
方案1:铝镁合金与足量盐酸反应,测定气体的质量为m 1g。
方案2:铝镁合金与足量氢氧化钠溶液反应,过滤、洗涤、烘干,测定剩余固体质量w1 g。
方案3:铝镁合金与过量的盐酸反应,在溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧,测定固体的质量w2 g。(说明:Al (OH)3 既可以与酸反应,也可以与碱反应)
(1)某化学实验小组利用如图所示的装置,按照方案1进行了实验。

实验装置中有两处明显错误,请指出至少一种:
(2)方案2中的化学方程式为
(3)方案3中“过滤”操作中用到玻璃棒,玻璃棒的作用是
您最近一年使用:0次
10 . 把5.1g镁和铝的粉末放入过量的盐酸中,得到0.5gH2。
(1)该合金中铝的质量分数_______ 。
(2)该合金中铝和镁物质的量之比是_______ 。
(1)该合金中铝的质量分数
(2)该合金中铝和镁物质的量之比是
您最近一年使用:0次



