1 . 氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_______ (选填编号)。
a.高炉炼铁 b.腐蚀印刷电路板 c.高温煅烧石灰石 d.燃放烟花炮竹
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。
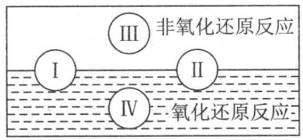
试写出有水参加且符合反应类型IV的一个化学方程式:_______ 。
(3)工业上利用 和
和 反应来制取单质
反应来制取单质 。
。
①配平下列化学方程式并标明电子转移的方向和数目:_______ 。
_____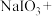 _____NaHSO3→_____
_____NaHSO3→_____
②该反应还原剂是____ ,____ 元素被还原,若生成1mol氧化产物则转移电子数目为___ NA。
(4)已知: 、
、 、
、 、
、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
_______ I-(填“ ”或“
”或“ ”),完成该反应
”),完成该反应_______ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a.高炉炼铁 b.腐蚀印刷电路板 c.高温煅烧石灰石 d.燃放烟花炮竹
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”可用下图表示。

试写出有水参加且符合反应类型IV的一个化学方程式:
(3)工业上利用
 和
和 反应来制取单质
反应来制取单质 。
。①配平下列化学方程式并标明电子转移的方向和数目:
_____
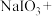 _____NaHSO3→_____
_____NaHSO3→_____
②该反应还原剂是
(4)已知:
 、
、 、
、 、
、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
 ”或“
”或“ ”),完成该反应
”),完成该反应
您最近一年使用:0次
名校
2 . Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料。也可用于镍粉的制造,其一种生产工艺如图。

有关氢氧化物开始沉淀和沉淀完全的pH如表:
(1)Ni2O3中Ni的化合价为___ 。
(2)“酸浸”时温度不宜过高的原因是__ 。
(3)加入H2O2“氧化”的目的是__ 。加入Na2CO3溶液调节溶液pH的范围为__ 。
(4)从滤液A中可回收利用的主要物质是__ 。
(5)加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为__ 。
(6)为测定样品中Ni2O3的质量分数。进行实验;称取5.000g样品。加入足量硫酸后再加入100mL1.0mol·L-1的Fe2+标准溶液。充分反应。加水定容至200mL.取出20.00mL。用0.040mol·L-1KMnO4标准溶液滴定。用去KMnO4标准溶液20.00mL。试通过计算确定Ni2O3的质量分数__ 。测定过程中涉及的反应如下:Ni2O3+2Fe2++6H+=2Ni2++2Fe3++3H2O;5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀时pH | 1.5 | 6.5 | 7.1 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.1 |
(2)“酸浸”时温度不宜过高的原因是
(3)加入H2O2“氧化”的目的是
(4)从滤液A中可回收利用的主要物质是
(5)加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为
(6)为测定样品中Ni2O3的质量分数。进行实验;称取5.000g样品。加入足量硫酸后再加入100mL1.0mol·L-1的Fe2+标准溶液。充分反应。加水定容至200mL.取出20.00mL。用0.040mol·L-1KMnO4标准溶液滴定。用去KMnO4标准溶液20.00mL。试通过计算确定Ni2O3的质量分数
 +8H+=5Fe3++Mn2++4H2O。
+8H+=5Fe3++Mn2++4H2O。
您最近一年使用:0次
2020-10-04更新
|
241次组卷
|
2卷引用:贵州省贵阳市2021届高三8月摸底考试化学试题
解题方法
3 . 化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是
A.家庭用的“ ”消毒液与洁厕灵不能同时混合使用,否则会生成对环境有害的气体 ”消毒液与洁厕灵不能同时混合使用,否则会生成对环境有害的气体 |
| B.黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
| C.铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应 |
| D.碳酸氢钠常用于治疗胃病 |
您最近一年使用:0次
名校
4 . 植物中山茶花、石榴可以吸收氯气,紫藤和月季对氯气的吸收净化能力也很强。在实验室制取Cl2时,尾气一般要用NaOH溶液吸收而不用澄清石灰水吸收的理由是( )
| A.氯气不与石灰水反应 |
| B.澄清石灰水能吸收空气中的CO2而变浑浊 |
| C.氯气与Ca(OH)2反应生成的CaCl2难溶于水 |
| D.Ca(OH)2微溶于水,澄清石灰水中Ca(OH)2的含量少,吸收的尾气也很少 |
您最近一年使用:0次
2020-11-29更新
|
165次组卷
|
4卷引用:贵州省正安县第二中学2019-2020学年高二上学期开学考试化学试题
名校
5 . 将氯气制成漂白粉的主要目的是( )
①使它转变成较易溶于水的物质
②转变成较稳定、便于贮存的物质
③提高氯的质量分数
④提高漂白能力
①使它转变成较易溶于水的物质
②转变成较稳定、便于贮存的物质
③提高氯的质量分数
④提高漂白能力
| A.①② | B.②③④ | C.②③ | D.② |
您最近一年使用:0次
2018-12-23更新
|
242次组卷
|
9卷引用:贵州省毕节市织金县第一中学2018-2019学年高一上学期12月份考试化学试题
贵州省毕节市织金县第一中学2018-2019学年高一上学期12月份考试化学试题贵州省正安县第二中学2019-2020学年高二上学期开学考试化学试题(已下线)2012年人教版高中化学必修一4.2 富集在海水中的元素-氯练习卷(已下线)【走进新高考】(人教版必修一)4.2.1富集在海水中的元素——氯 (氯气) 同步练习01云南省元江县一中2020届高三上学期开学考试化学试题云南省永平县第二中学2019-2020学年高一上学期期末考试化学试题河南省郑州市河南省实验中学2019-2020学年高一上学期第一次月考化学试题广东省乐昌市第二中学2020-2021学年高一上学期期中考试化学试题广东省普宁市华侨中学2021-2022学年高一上学期期中考试化学试题
6 . 工业生产纯碱的工艺流程示意图如下:
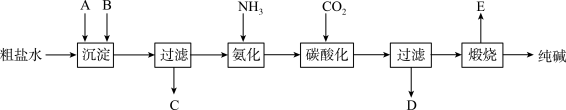
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A__________________________________ B__________________________________
(2)实验室提纯粗盐的实验操作依次为:
取样、______ 、沉淀、______ 、______ 、冷却结晶、______ 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是____________________________ 。
碳酸化时没有析出碳酸钠晶体,其原因是_______________________________________ 。
(4)碳酸化后过滤,滤液D最主要的成分是_____________________________ (填写化学式),检验这一成分的阴离子的具体方法是:________________________________________ 。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:_________________________________________________________
滤液D加石灰水前先要加热,原因是_____________________________________________ 。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
_____________________________________________________________________________
(注明你的表达式中所用的有关符号的含义)

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A
(2)实验室提纯粗盐的实验操作依次为:
取样、
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是
碳酸化时没有析出碳酸钠晶体,其原因是
(4)碳酸化后过滤,滤液D最主要的成分是
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:
滤液D加石灰水前先要加热,原因是
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
您最近一年使用:0次
2019-01-30更新
|
2002次组卷
|
6卷引用:2014届贵州省遵义市高三五校联考理综化学试卷
(已下线)2014届贵州省遵义市高三五校联考理综化学试卷贵州省余庆中学2019-2020学年上学期开学考试高三化学试题2010年全国普通高等学校招生统一考试上海卷化学试题2010年高考化学试题分项专题十五 化学实验(已下线)2011届湖北省天门市高三模拟考试(一)(理综)化学部分2020届高三化学大二轮增分强化练——化学工艺流程题
名校
7 . 金属的使用是人类拓展自身能力的标志之一。人类利用几种常用金属的先后顺序依次为金、铜、铁、铝,之所以有先后,主要取决于
| A.金属在地壳中的含量多少 | B.金属的熔沸点高低 |
| C.金属的活泼性强弱 | D.金属的导电性强弱 |
您最近一年使用:0次
2016-12-09更新
|
934次组卷
|
7卷引用:贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高三上学期期末考试化学试题



