1 . 火药是中国的四大发明之一、坊间一直流传黑火药的配方为“一硫、二硝、三木炭”,黑火药爆炸时发生的反应为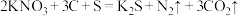 。下列有关说法正确的是
。下列有关说法正确的是
 。下列有关说法正确的是
。下列有关说法正确的是| A.黑火药中所含元素均为短周期元素 |
B.当转移3mol 时,有22.4L气体生成 时,有22.4L气体生成 |
| C.黑火药中C的质量分数大约为50% |
| D.参加反应的还原剂与氧化剂的物质的量之比为1∶1 |
您最近一年使用:0次
2023-02-13更新
|
174次组卷
|
3卷引用:陕西省榆林市2022-2023学年高一上学期期末检测化学试题
名校
2 . 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的 质量进行计算,某同学设计的实验装置示意图如下:
质量进行计算,某同学设计的实验装置示意图如下:

下列说法错误的是
 质量进行计算,某同学设计的实验装置示意图如下:
质量进行计算,某同学设计的实验装置示意图如下:
下列说法错误的是
| A.仪器a中试剂的作用是防止外界的水蒸气与二氧化碳进入装置C中 |
| B.装置B中冰水的作用是冷凝反应生成的水 |
| C.样品分解不完全可能使碳酸钠的质量分数偏低 |
D.产生 气体的速率太快,没有被碱石灰完全吸收可能使碳酸钠的质量分数偏低 气体的速率太快,没有被碱石灰完全吸收可能使碳酸钠的质量分数偏低 |
您最近一年使用:0次
2022-10-22更新
|
143次组卷
|
3卷引用:陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题
22-23高一上·全国·课时练习
名校
3 . X、Y、Z、W、R五种元素的性质或结构信息如表,根据表中的信息回答下列问题:
(1)写出元素R在元素周期表中的位置:_______ 。
(2)由X、Z、R三种元素形成的化合物XRZ的分子式为_______ 。
(3)W与Z的单质在加热条件反应的化学方程式是_______ 。
(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:_______ ,燃烧片刻后取出燃烧管,迅速将集气瓶倒扣在过量的烧碱溶液中,可能产生的现象是_______ ,所得溶液中存在的溶质除了过量的NaOH外,还含有的是_______ (填化学式)。
| 元素 | X | Y | Z | W | R |
| 性质或 结构信息 | 单质是最轻的气体 | 常见单质为空气中的主要成分之一 | 是海水中质量分数最大的元素 | 原子核内有11个质子 | 原子核外有3个电子层,常见单质为气体 |
(2)由X、Z、R三种元素形成的化合物XRZ的分子式为
(3)W与Z的单质在加热条件反应的化学方程式是
(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:
您最近一年使用:0次
4 . 某补钙剂的主要成分是碳酸钙。欲测定该补钙剂中碳酸钙的质量分数,某同学进行了如图所示的操作(假设其它成分可溶于水但不参与反应)。

(1)该实验中,装置的气密性对测定结果_______ (填“有”或“无”)影响。
(2)计算该补钙剂中碳酸钙的质量分数_______ (写出计算步骤)。

(1)该实验中,装置的气密性对测定结果
(2)计算该补钙剂中碳酸钙的质量分数
您最近一年使用:0次
名校
解题方法
5 . W、X、Y、Z是原子序数依次增大的短周期主族元素,W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,Y的一种单质在空气中含量最高。下列有关说法正确的是
A.简单离子的半径: |
B.简单氢化物的稳定性: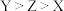 |
C.最高价氧化物对应水化物的酸性: |
| D.W、Y、Z既能形成共价化合物又能形成离子化合物 |
您最近一年使用:0次
2023-01-16更新
|
318次组卷
|
2卷引用:陕西省西安市第八十九中学2022-2023学年高一下学期开学考试化学试题
6 . X、Y、Z、M、Q五种短周期主族元素的原子序数依次增大,其中X、Y、Z、M同周期,X的最外层电子数与最内层电子数相等,Y的一种同位素可用于考古工作的年代测定,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法中错误的是
| A.X的最高价氧化物对应的水化物可能难溶于水 |
| B.M与Q形成的两种化合物均为碱性氧化物 |
| C.非金属性:M>Z>Y |
D.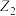 性质很稳定,通常用作保护气 性质很稳定,通常用作保护气 |
您最近一年使用:0次
2023-02-13更新
|
187次组卷
|
3卷引用:陕西省榆林市2022-2023学年高一上学期期末检测化学试题
名校
7 . 下列有关金属铝及其化合物的叙述正确的是
| A.铝是地壳里含量最多的元素 |
| B.在常温下,铝不能与氧气反应 |
| C.在常温下,可以用铝制容器盛装冷的浓硫酸 |
| D.氧化铝只能与酸反应,不能与强碱反应 |
您最近一年使用:0次
2023-01-23更新
|
184次组卷
|
3卷引用:陕西省西安市第八十九中学2022-2023学年高一下学期开学考试化学试题
名校
解题方法
8 . 重庆多地曾出现过盐井,从天然盐井中获取粗盐(含泥沙、 、
、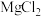 、
、 等杂质)为了除去以上杂质得到精盐,小明设计如下实验。
等杂质)为了除去以上杂质得到精盐,小明设计如下实验。
【提示】杂质含量较少,不考虑微溶物形成沉淀
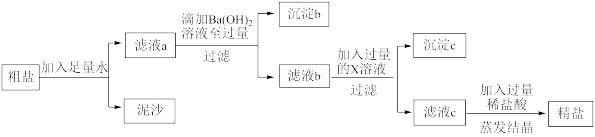
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(2)沉淀b所含物质为 和
和___________ 。
(3)物质X是___________ 。
(4)滤液c中加入稀盐酸后发生反应的离子方程式为___________ 、___________ 。
(5)为了证明滴加的 溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有___________。
溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有___________。
 、
、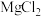 、
、 等杂质)为了除去以上杂质得到精盐,小明设计如下实验。
等杂质)为了除去以上杂质得到精盐,小明设计如下实验。【提示】杂质含量较少,不考虑微溶物形成沉淀

(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和
(2)沉淀b所含物质为
 和
和(3)物质X是
(4)滤液c中加入稀盐酸后发生反应的离子方程式为
(5)为了证明滴加的
 溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有___________。
溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有___________。A. | B. | C. | D.KCl |
您最近一年使用:0次
2022-10-23更新
|
124次组卷
|
2卷引用:陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题
名校
9 . 二氧化氯(ClO2)是一种高效消毒灭菌剂。某化学兴趣小组设计如图装置制备二氧化氯。
②ClO2+NaOH→NaCl+NaClO3+H2O(未配平)。
(1)装置A中盛装Na2S2O3的仪器名称为____ ;装置E中ClO2与NaOH的反应中还原剂与氧化剂的质量之比为____ ,装置E中倒置漏斗的作用是____ 。
(2)装置C中制得ClO2的同时还有硫酸的酸式盐生成,该反应的化学方程式为____ 。
(3)ClO2溶液现配现用,用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取20.00mLClO2溶液于锥形瓶中;
步骤2:调节锥形瓶中溶液pH≤2.0,再加入足量的KI晶体,静置片刻;
步骤3:加入2~3滴淀粉溶液作指示剂,用0.050mol·L-1的Na2S2O3溶液滴定至终点,进行平行实验3次,消耗Na2S2O3溶液的平均体积为16.00mL。[Na2S2O3+I2→Na2S2O6+NaI(未配平),Na2S2O3溶液不稳定易被氧化]
①Na2S2O3溶液应放在____ (填“酸式”或“碱式”)滴定管中;步骤2中反应的离子方程式为____ 。
②步骤3中,判断滴定达到终点的标志是____ 。
③根据实验数据,可算出原ClO2溶液中ClO2的浓度为____ mg·L-1。
④你认为下列可能造成测得的ClO2溶液中ClO2的物质的量浓度偏小的原因有____ (填标号)。
a.滴定管尖嘴处,滴定前有气泡,滴定后无气泡
b.滴定过程中由于振荡过于剧烈,使少量液体洒出锥形瓶
c.滴定前仰视Na2S2O3液面,滴定后俯视Na2S2O3液面
d.滴定中使用的Na2S2O3溶液敞口放置较长时间
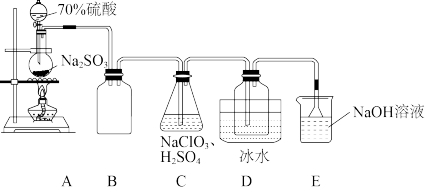
②ClO2+NaOH→NaCl+NaClO3+H2O(未配平)。
(1)装置A中盛装Na2S2O3的仪器名称为
(2)装置C中制得ClO2的同时还有硫酸的酸式盐生成,该反应的化学方程式为
(3)ClO2溶液现配现用,用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取20.00mLClO2溶液于锥形瓶中;
步骤2:调节锥形瓶中溶液pH≤2.0,再加入足量的KI晶体,静置片刻;
步骤3:加入2~3滴淀粉溶液作指示剂,用0.050mol·L-1的Na2S2O3溶液滴定至终点,进行平行实验3次,消耗Na2S2O3溶液的平均体积为16.00mL。[Na2S2O3+I2→Na2S2O6+NaI(未配平),Na2S2O3溶液不稳定易被氧化]
①Na2S2O3溶液应放在
②步骤3中,判断滴定达到终点的标志是
③根据实验数据,可算出原ClO2溶液中ClO2的浓度为
④你认为下列可能造成测得的ClO2溶液中ClO2的物质的量浓度偏小的原因有
a.滴定管尖嘴处,滴定前有气泡,滴定后无气泡
b.滴定过程中由于振荡过于剧烈,使少量液体洒出锥形瓶
c.滴定前仰视Na2S2O3液面,滴定后俯视Na2S2O3液面
d.滴定中使用的Na2S2O3溶液敞口放置较长时间
您最近一年使用:0次
2022-08-23更新
|
372次组卷
|
4卷引用:陕西省西安市2023届高三上学期8月联考化学试题
名校
10 . 用如图装置进行实验。下列现象能证明空气中O2的含量的是:


| A.红磷燃烧,产生白烟 | B.瓶中液面先下降,后上升 |
| C.瓶中液面最终上升至1处 | D.水槽中液面下降 |
您最近一年使用:0次



