名校
1 . I.单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。
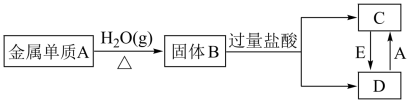
(1)试判断:A的化学式为___________ ,按图中要求写出A→B的化学反应方程式___________ 。
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___________ 色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为___________ 色,则含该离子。
(3)实验室检验D溶液中的阳离子时,通常可滴加___________ 溶液,若溶液变为红色,则含该离子。
Ⅱ.如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。
(4)若实验室用该浓硫酸配制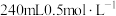 的稀硫酸,请计算需要该浓硫酸
的稀硫酸,请计算需要该浓硫酸___________ mL(精确到小数点后1位)。
(5)下列操作将导致所配制的 溶液浓度偏大的是
溶液浓度偏大的是___________ 。
a.移液过程有 溶液溅出瓶外
溶液溅出瓶外
b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线
d.加水超过刻度线,用胶头滴管吸出多余液体
e.洗涤时将量筒洗涤液也加入容量瓶

(1)试判断:A的化学式为
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生
(3)实验室检验D溶液中的阳离子时,通常可滴加
Ⅱ.如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。
| 硫酸化学纯(CP) 品名:硫酸 化学式:  相对分子质量:98 密度:  质量分数:98% |
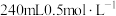 的稀硫酸,请计算需要该浓硫酸
的稀硫酸,请计算需要该浓硫酸(5)下列操作将导致所配制的
 溶液浓度偏大的是
溶液浓度偏大的是a.移液过程有
 溶液溅出瓶外
溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线
d.加水超过刻度线,用胶头滴管吸出多余液体
e.洗涤时将量筒洗涤液也加入容量瓶
您最近一年使用:0次
2023-04-13更新
|
163次组卷
|
2卷引用:内蒙古阿拉善盟第一中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
2 . 过氧化钠常作漂白剂、杀菌剂、消毒剂.过氧化钠保存不当会变质.某课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数.

(1)将仪器连接好以后,必须进行的第一步操作是_______ .
(2)装置B的作用是_______ (用化学反应方程式表示).
(3)D中NaOH溶液的作用_______ .
(4)装置C中发生反应的化学方程式有_______ 、_______ .
(5)实验结束时,读取实验中生成气体的体积时,不合理的是_______ (填字母).
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与量筒凹液面的最低点相平,读取量筒中水的体积
(6)读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,已知标准状况下氧气的密度为ρ g/L,则样品中过氧化钠的质量分数为_______ .
(7)实验完成后,E到F之间导管内残留水的体积会使测量结果_______ (填“偏大”、“偏小”或“不影响”).

(1)将仪器连接好以后,必须进行的第一步操作是
(2)装置B的作用是
(3)D中NaOH溶液的作用
(4)装置C中发生反应的化学方程式有
(5)实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与量筒凹液面的最低点相平,读取量筒中水的体积
(6)读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,已知标准状况下氧气的密度为ρ g/L,则样品中过氧化钠的质量分数为
(7)实验完成后,E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
名校
3 . 2021年6月11日国家航天局公布了由“祝融号”火星车拍摄的首批科学影像图。火星气体及岩石中富含X、Y、Z、W四种元素。已知:X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与热水反应后溶液能使酚酞试液变为浅红色,X、W为同一主族元素,Y是地球地壳中含量最高的元素,火星岩石含有ZWY3。下列判断正确的是
| A.W位于元素周期表第三周期ⅤA族 | B.最高价含氧酸的酸性:X<W |
| C.原子半径:Z>W>Y>X | D.X和Y可形成不止一种化合物 |
您最近一年使用:0次
2023-05-04更新
|
593次组卷
|
4卷引用:内蒙古阿拉善盟2022-2023学年高一下学期期末考试化学试题
内蒙古阿拉善盟2022-2023学年高一下学期期末考试化学试题陕西省西安市长安区第一中学2022-2023学年高一上学期期末考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元03巩固练(已下线)【定心卷】4.2.2 元素周期表和元素周期律的应用随堂练习-人教版2023-2024学年必修第一册
名校
4 . 某氯化镁溶液的密度为 1.16 g·cm−3,其中氯化镁的质量分数为 16.3%,500 mL 该溶液中 Cl−的物质的量浓度约等于( )
| A.4.0 mol·L−1 | B.2.4 mol·L−1 | C.2.1 mol·L−1 | D.1.26 mol·L−1 |
您最近一年使用:0次
2020-08-27更新
|
30次组卷
|
2卷引用:内蒙古自治区阿拉善盟第一中学2021-2022学年高一上学期期末考试化学试题
5 . 下图是地壳中含量较大的九种元素分布图,图中X、Y、Z分别表示不同元素。

回答下列问题:
(1)X的名称为________ ,硅元素在自然界以______ (填"游离态"或“化合态”)形式存在。
(2)Y的氧化物属于______ 氧化物, 硅的氧化物属于______ 氧化物(填“酸性”、 “两性”或“碱性" )。
(3)常用ZCl3溶液作为刻制印刷电路时的“腐蚀液" ,该反应的离子方程式为__________ ,区别ZCl3溶液和Z(OH)3胶体的方法是__________ 。
(4)由粗硅制备硅烷(SiH4)的基本流程如下图所示(反应条件均省略):

已知:反应I、II的化学方程式分别为Si+3HCl=SiHCl3+A,SiHCl3+A=Si+3HCl( 均已配平)。
①A的化学式为_______ 。
②反应I、II、III中,有_______ 个属于氧化还原反应。
③反应IV中生成的SiH4和NH3两种气体的物质的量之比为_______ 。

回答下列问题:
(1)X的名称为
(2)Y的氧化物属于
(3)常用ZCl3溶液作为刻制印刷电路时的“腐蚀液" ,该反应的离子方程式为
(4)由粗硅制备硅烷(SiH4)的基本流程如下图所示(反应条件均省略):

已知:反应I、II的化学方程式分别为Si+3HCl=SiHCl3+A,SiHCl3+A=Si+3HCl( 均已配平)。
①A的化学式为
②反应I、II、III中,有
③反应IV中生成的SiH4和NH3两种气体的物质的量之比为
您最近一年使用:0次
2020-08-20更新
|
602次组卷
|
2卷引用:内蒙古自治区阿拉善盟第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
6 . 2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(主要成分为Co2O3)制备LiCoO2的工艺流程如图:

资料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1- CoCl42-
CoCl42-
(1)若“X试剂”是稀H2SO4和H2O2,则H2O2的作用是___ 。
(2)若“X试剂”是盐酸,写出离子反应方程式___ 。
(3)途径I中加入NaCl固体的目的___ (用平衡移动原理解释)。
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高的原因是___ 。
(5)已知M是钴的某种氧化物,63.6gCo2(OH)2CO3,煅烧成物质M时转移电子0.4mol,则M的化学式为___ ;写出“烧结”的化学方程式___ 。
(6)取mg样品溶于稀硫酸,加入过量KI溶液,再用cmol·L-1Na2S2O3标准液滴定(淀粉溶液做指示剂),达到滴定终点时,消耗Na2S2O3溶液VmL,则产品中钻元素的百分含量为___ 。
(有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)

资料:在含一定量Cl-的溶液中,Co2+以CoCl42-形式存在:Co2++4C1-
 CoCl42-
CoCl42-(1)若“X试剂”是稀H2SO4和H2O2,则H2O2的作用是
(2)若“X试剂”是盐酸,写出离子反应方程式
(3)途径I中加入NaCl固体的目的
(4)“沉钴”过程中,为了提高Co2(OH)2CO3的产量,温度不宜过高的原因是
(5)已知M是钴的某种氧化物,63.6gCo2(OH)2CO3,煅烧成物质M时转移电子0.4mol,则M的化学式为
(6)取mg样品溶于稀硫酸,加入过量KI溶液,再用cmol·L-1Na2S2O3标准液滴定(淀粉溶液做指示剂),达到滴定终点时,消耗Na2S2O3溶液VmL,则产品中钻元素的百分含量为
(有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2,I2+2S2O32-=S4O62-+2I-)
您最近一年使用:0次
2020-05-13更新
|
293次组卷
|
3卷引用:内蒙古自治区阿拉善盟第一中学2021-2022学年高二下学期期末考试化学试题
14-15高三上·甘肃兰州·期中
名校
解题方法
7 . 硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示
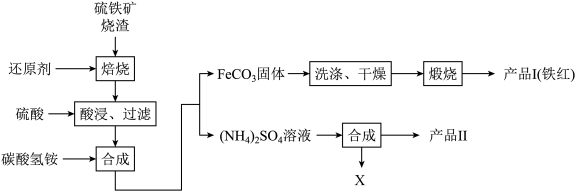
回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为___________ 。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为___________ 。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是___________ 。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为___________ ,反应的离子方程式为___________ 。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为___________ 。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,___________ 。

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
您最近一年使用:0次
2016-12-09更新
|
231次组卷
|
3卷引用:内蒙古阿拉善左旗高级中学 2018届高三10月月考理综化学试题



