解题方法
1 . 在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是___________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是_______________________________________________ 。
乙同学认为是O2,其可能的理由是______________________________________________ 。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_________________ 。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为________________________________________ 。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为________ mol·L-1;铁钉中单质铁的质量分数为____________ 。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是
乙同学认为是O2,其可能的理由是
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 两投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
所配硫酸的物质的量浓度为
您最近一年使用:0次
2020-09-22更新
|
104次组卷
|
2卷引用:内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题
解题方法
2 . 化学与人类生活密切相关,现有以下物质:①漂白粉 ②冰醋酸(纯醋酸) ③葡萄糖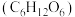 ④胆矾
④胆矾 ⑤干冰 ⑥Cu。请回答下列问题:
⑤干冰 ⑥Cu。请回答下列问题:
(1)以上物质中属于电解质的是________ (填序号)。
(2)医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。
如图是输液用的葡萄糖(相对分子质量为180)注射液的标签。
①该注射液中葡萄糖的物质的量浓度为________ 。
②实验室需要480mL该浓度的葡萄糖溶液,配制该浓度的溶液需要用普通电子天平称量________ g葡萄糖固体。
③配制该溶液需要用到的玻璃仪器除了烧杯和玻璃棒外,还缺少________ 、________ 。
(3)下列操作会使所配制的溶液物质的量浓度偏低的是________(填序号)。
(4)人体血糖(血液中的葡萄糖)正常值为3.9~6.1mmol/L。某人体检报告血糖值检测结果为0.92g/L,则他(她)的血糖值________ (填“偏高”“正常”或“偏低”)。
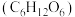 ④胆矾
④胆矾 ⑤干冰 ⑥Cu。请回答下列问题:
⑤干冰 ⑥Cu。请回答下列问题:(1)以上物质中属于电解质的是
(2)医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。
如图是输液用的葡萄糖(相对分子质量为180)注射液的标签。
| 葡萄糖注射液 规格:500mL 密度:1.08g/mL 质量分数:5% 生产批号:10032032 |
②实验室需要480mL该浓度的葡萄糖溶液,配制该浓度的溶液需要用普通电子天平称量
③配制该溶液需要用到的玻璃仪器除了烧杯和玻璃棒外,还缺少
(3)下列操作会使所配制的溶液物质的量浓度偏低的是________(填序号)。
| A.配制溶液所用的容量瓶洗涤后没有干燥 |
| B.转移溶液后,没有洗涤烧杯和玻璃棒 |
| C.定容时俯视刻度线 |
| D.定容时加水超过刻度线,把溶液倒出一些,重新加水至刻度线 |
您最近一年使用:0次
2024-01-12更新
|
80次组卷
|
2卷引用:内蒙古呼和浩特市2023-2024学年高一上学期期末教学质量检测化学试卷
名校
解题方法
3 . 硫酸铁铵可用作媒染剂和制药,其晶体化学式为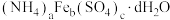 。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:
。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:

(1)步骤①中发生的离子方程式为:_______ 。步骤④为灼烧,该过程在_______ 中进行(填仪器名称)。
(2)实验中需配制500 mL 1.00 mol/L的硫酸,则需要量取质量分数为98%,密度为1.84g/mL的浓硫酸_______ mL,若在量取浓硫酸时俯视,则配制的稀硫酸的浓度将_______ (填“偏大”或“偏小”或“不变”),配制过程中不需要用到的仪器是_______ (填字母)。除图中已有仪器外,还缺少的玻璃仪器是_______ 。

(3)步骤②中加入足量 的目的是氧化
的目的是氧化 ,该步骤中发生的离子方程式为:
,该步骤中发生的离子方程式为:_______ 。
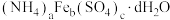 。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:
。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:
(1)步骤①中发生的离子方程式为:
(2)实验中需配制500 mL 1.00 mol/L的硫酸,则需要量取质量分数为98%,密度为1.84g/mL的浓硫酸

(3)步骤②中加入足量
 的目的是氧化
的目的是氧化 ,该步骤中发生的离子方程式为:
,该步骤中发生的离子方程式为:
您最近一年使用:0次
名校
4 . Ⅰ.某同学欲用密度为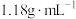 、质量分数为36.5%的浓盐酸配制220mL
、质量分数为36.5%的浓盐酸配制220mL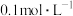 稀盐酸,请你帮助他完成这一任务。
稀盐酸,请你帮助他完成这一任务。

(1)应量取的浓盐酸体积______ mL,应选用的容量瓶的规格______ mL。
(2)在配制溶液的过程中,如图所示仪器还需增加的玻璃仪器除了烧杯还有______ (填仪器名称)。
(3)在配制稀盐酸溶液时:
①其正确的操作顺序是______ (用字母符号表示,每个符号只能用一次)。
A.用30mL蒸馏水洗涤玻璃仪器各2~3次,洗涤液全部注入容量瓶并轻摇容量瓶
B.用量筒准确量取所需体积的浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
C.将已恢复至室温的盐酸移液操作注入所选用的容量瓶中
D.盖好瓶塞,反复上下颠倒摇匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
②下列操作可能使所配溶液浓度偏高的是______ (填字母)。
A.没有进行操作A
B.没有进行操作C
C.定容俯视容量瓶瓶颈上的刻度线
D.加蒸馏水不慎超过容量瓶瓶颈上的刻度线
E.容量瓶用蒸馏水洗净后,没烘干直接使用
③若实验中出现以下情况,应该怎么处理:向容量瓶中转移溶液时(操作C)不慎将少量溶液洒到容量瓶外面:______ 。
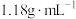 、质量分数为36.5%的浓盐酸配制220mL
、质量分数为36.5%的浓盐酸配制220mL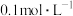 稀盐酸,请你帮助他完成这一任务。
稀盐酸,请你帮助他完成这一任务。
(1)应量取的浓盐酸体积
(2)在配制溶液的过程中,如图所示仪器还需增加的玻璃仪器除了烧杯还有
(3)在配制稀盐酸溶液时:
①其正确的操作顺序是
A.用30mL蒸馏水洗涤玻璃仪器各2~3次,洗涤液全部注入容量瓶并轻摇容量瓶
B.用量筒准确量取所需体积的浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
C.将已恢复至室温的盐酸移液操作注入所选用的容量瓶中
D.盖好瓶塞,反复上下颠倒摇匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
②下列操作可能使所配溶液浓度偏高的是
A.没有进行操作A
B.没有进行操作C
C.定容俯视容量瓶瓶颈上的刻度线
D.加蒸馏水不慎超过容量瓶瓶颈上的刻度线
E.容量瓶用蒸馏水洗净后,没烘干直接使用
③若实验中出现以下情况,应该怎么处理:向容量瓶中转移溶液时(操作C)不慎将少量溶液洒到容量瓶外面:
您最近一年使用:0次
解题方法
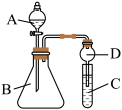
5 . 某兴趣小组模拟工业制漂白粉,设计了如图所示的实验装置。
②温度高时,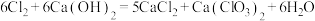 。
。
请回答下列问题:
(1)圆底烧瓶内发生反应的离子方程式为______ ;该反应中的氧化剂是______ ;装置乙中饱和食盐水的作用是______ 。
(2)该小组制得的漂白粉中 的量远大于
的量远大于 的量,其主要原因是
的量,其主要原因是______ ;为提高 的含量,可采取的措施是
的含量,可采取的措施是______ (任写一种即可)。
(3) 是有毒气体,为了防止多余
是有毒气体,为了防止多余 污染空气,可以在丁处用如图装置进行尾气处理,用化学方程式表示该原理
污染空气,可以在丁处用如图装置进行尾气处理,用化学方程式表示该原理______ 。气体应该由______ (填“a”或“b”)口通入。
②温度高时,
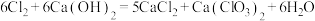 。
。请回答下列问题:
(1)圆底烧瓶内发生反应的离子方程式为
(2)该小组制得的漂白粉中
 的量远大于
的量远大于 的量,其主要原因是
的量,其主要原因是 的含量,可采取的措施是
的含量,可采取的措施是(3)
 是有毒气体,为了防止多余
是有毒气体,为了防止多余 污染空气,可以在丁处用如图装置进行尾气处理,用化学方程式表示该原理
污染空气,可以在丁处用如图装置进行尾气处理,用化学方程式表示该原理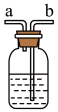
您最近一年使用:0次
解题方法
6 . 某学生学习了检验食品中的铁元素后,设想在课外研究测定某补血剂中铁元素(+2价)含量,其设计实验流程如下:
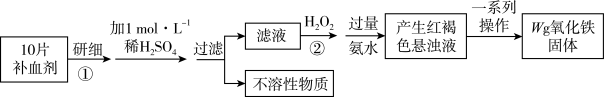
下列说法错误的是

下列说法错误的是
A.步骤②可以用新制氯水替代 |
B.步骤②加入氨水的作用是将 完全沉淀 完全沉淀 |
| C.每片补血剂中含铁元素的质量为0.07Wg |
| D.取步骤①操作后的溶液,滴加几滴KSCN溶液,若溶液变红,证明补血剂已完全被氧化变质 |
您最近一年使用:0次
2024-02-03更新
|
123次组卷
|
2卷引用:内蒙古呼和浩特市2023-2024学年高一上学期期末教学质量检测化学试卷
7 . 某化学实验室需要0.5 硫酸溶液450
硫酸溶液450 。根据溶液的配制情况回答下列问题:
。根据溶液的配制情况回答下列问题:
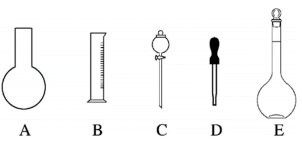
(1)如图所示的仪器中配制溶液肯定不需要的是_______ (填序号),本实验所需玻璃仪器E的规格和名称是_______ ;
(2)现用质量分数为98%、密度为1.84 的浓硫酸来配制450
的浓硫酸来配制450 、0.5
、0.5 的稀硫酸。计算所需浓硫酸的体积为
的稀硫酸。计算所需浓硫酸的体积为_______  ,现有10
,现有10 、25
、25 、50
、50 、100
、100 四种规格的量筒,你选用的量筒是
四种规格的量筒,你选用的量筒是_______ ;
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_______ ;
(4)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇勺⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为:②→①→③→_______ →_______ →_______ →_______ →④(填序号)。
(5)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_______ 0.5 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
 硫酸溶液450
硫酸溶液450 。根据溶液的配制情况回答下列问题:
。根据溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是

(2)现用质量分数为98%、密度为1.84
 的浓硫酸来配制450
的浓硫酸来配制450 、0.5
、0.5 的稀硫酸。计算所需浓硫酸的体积为
的稀硫酸。计算所需浓硫酸的体积为 ,现有10
,现有10 、25
、25 、50
、50 、100
、100 四种规格的量筒,你选用的量筒是
四种规格的量筒,你选用的量筒是(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
(4)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇勺⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为:②→①→③→
(5)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度
 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
您最近一年使用:0次
解题方法
8 . 短周期主族元素X、Y、Z、M、Q都可能存在于某些食品添加剂中,且它们的原子序数依次增大。X原子最外层电子数等于电子层数的2倍,Y元素是蛋白质的组成元素之一,在生命活动中起重要作用;Z是地壳中含量最多的元素;Z、M元素的原子最外层电子数相同。请回答下列问题:
(1)化合物 是
是_______ 化合物(填“离子”或“共价”),其中含有的化学键类型为_______ (填“离子键”、“极性共价键”或“非极性共价键”)。
(2)M离子、Q离子中半径较大的是_______ (用离子符号表示)。
(3)Z能形成多种同素异形体,如_______ 、_______ (填化学式)等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)主族元素砷( )的部分信息如图所示。
)的部分信息如图所示。
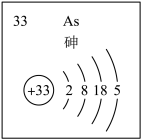
①砷( )在周期表中的位置是
)在周期表中的位置是_______ 。
②下列说法有误的一项为_______ (填序号)。
a.砷元素的最高化合价为 价
价
b.气态氢化物的稳定性: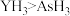
c.砷( )位于金属与非金属分界处,可能用于研发半导体材料
)位于金属与非金属分界处,可能用于研发半导体材料
(5)已知硅酸是一种难溶于水的白色胶状沉淀,若用下图所示装置证明非金属性: ,以下是实验中可能用到的物质,则其中试剂A为
,以下是实验中可能用到的物质,则其中试剂A为_______ ,试剂C为_______ (填序号)。
①稀盐酸 ②稀硫酸 ③碳酸钙 ④ 溶液 ⑤
溶液 ⑤ 溶液 ⑥碳酸钠
溶液 ⑥碳酸钠
(1)化合物
 是
是(2)M离子、Q离子中半径较大的是
(3)Z能形成多种同素异形体,如
(4)主族元素砷(
 )的部分信息如图所示。
)的部分信息如图所示。
①砷(
 )在周期表中的位置是
)在周期表中的位置是②下列说法有误的一项为
a.砷元素的最高化合价为
 价
价b.气态氢化物的稳定性:
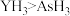
c.砷(
 )位于金属与非金属分界处,可能用于研发半导体材料
)位于金属与非金属分界处,可能用于研发半导体材料(5)已知硅酸是一种难溶于水的白色胶状沉淀,若用下图所示装置证明非金属性:
 ,以下是实验中可能用到的物质,则其中试剂A为
,以下是实验中可能用到的物质,则其中试剂A为
①稀盐酸 ②稀硫酸 ③碳酸钙 ④
 溶液 ⑤
溶液 ⑤ 溶液 ⑥碳酸钠
溶液 ⑥碳酸钠
您最近一年使用:0次
名校
9 . 我国科学家用下列实验研究硫酸盐会加剧雾霾的原因,以N2或空气为载气,将SO2和NO2按一定比例混合,通入不同吸收液,相同时间后,检测吸收液中 的含量,数据如下:下列说法正确的是
的含量,数据如下:下列说法正确的是
 的含量,数据如下:下列说法正确的是
的含量,数据如下:下列说法正确的是| 反应 | 载气 | 吸收液 |  含量 含量 | 数据分析 |
| ① | N2 | 蒸馏水 | a | i. b≈d﹥a≈c ii. 若起始时不通入NO2,则最终检测不到  |
| ② | 3%氨水 | b | ||
| ③ | 空气 | 蒸馏水 | c | |
| ④ | 3%氨水 | d |
| A.SO2的水溶液能导电,所以SO2属于电解质 |
| B.反应①中还原产物可能是HNO3 |
C.产生 的反应中NO2表现了氧化性 的反应中NO2表现了氧化性 |
| D.实验表明硫酸盐的形成主要与空气中的O2有关 |
您最近一年使用:0次
10 . 用氧化还原滴定法测定TiO2的质量分数;一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe( SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
(1)配制NH4Fe( SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的____________________________ (填字母代号)。

(2)滴定终点的现象是__________________________________________________ 。
(3)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe( SO4)2标准溶液V mL,则TiO2质量分数表达式为______________________________ 。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________________________________________________________ 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________________ 。
(1)配制NH4Fe( SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的

(2)滴定终点的现象是
(3)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe( SO4)2标准溶液V mL,则TiO2质量分数表达式为
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果
您最近一年使用:0次



