1 . 在抗击新冠肺炎疫情的战役中,84消毒液发挥着重要作用。实验小组对其进行研究。
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:
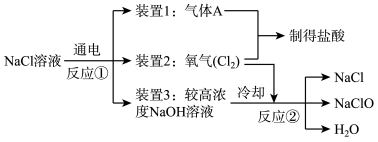
(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是___ 。
(2)写出反应②的化学方程式___ 。
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
实验2:探究84消毒液漂白性的影响因素:
【解释与结论】
(3)实验1的目的是___ 。
(4)实验2得出影响84消毒液失效的因素是___ 。
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是___ 。
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)
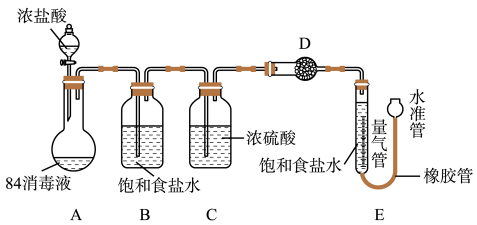
实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作___ 。
(7)装置B的作用是___ ,D中的试剂是___ (填字母序号)。
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是___ (填字母序号)。
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5%-6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发生变性反应时变为白色固体物质。
②ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:

(1)装置1必须保证气密性良好并在其周围严禁明火,其原因是
(2)写出反应②的化学方程式
Ⅱ.探究84消毒液
实验1:在鸡蛋清中加入不同浓度的消毒液,静置15min现象如表:
| 序号 | 1-1 | 1-2 | 1-3 | 1-4 |
| 实验操作 | 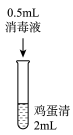 | 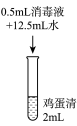 | 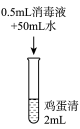 |  |
| 实验现象 | 实验液体表面产生大量气泡,无其他现象 | 液体中产生大量白色固体 | 液体中产生少量白色固体 | 液体中产生极少量白色固体 |
| 序号 | 2-1 | 2-2 |
| 实验操作 | 取烧杯倒入30mL浓度为1:100的84消毒液,将烧杯放置在距离光源10cm处进行光照,测量ORP变化 | 取四个烧杯,分别倒入30mL浓度为1:100的84消毒液,并置于20℃、30℃、40℃、50℃水溶中加热,测量ORP变化 |
| 测量数据 | 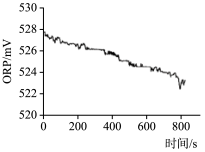 | 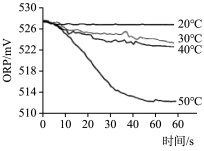 |
(3)实验1的目的是
(4)实验2得出影响84消毒液失效的因素是
【反思与评价】
(5)生活中,84消毒液不能与洁厕灵(主要成分是盐酸)混合使用的原因是
Ⅲ.定量检测某品牌84消毒液中NaClO含量
依据原理:2HCl(浓)+NaClO═NaCl+Cl2↑+H2O
已知:①氯气的密度为3.17g/L;
②氯气可溶于水,且会与水反应,但基本不溶于饱和食盐水。
③氯化氢气体极易溶于水。
实验探究:测“84消毒液”样品中NaClO的质量分数。(不考虑消毒液中NaClO以外的物质与浓盐酸反应)

实验过程:
①连接装置并检查气密性;②准确称量10g“84消毒液”样品;③装药品,调节量气装置两边液面相平,读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥,读取量气管数值224mL。
(6)补全步骤⑥中的操作
(7)装置B的作用是
a.碱石灰
b.浓硫酸
c.硫酸铜
(8)若其它操作均正确,仅因下列因素可使样品中NaClO的质量分数的测定结果偏小的是
a.反应前量气管水面到0刻度处,反应后仰视读数
b.装置A中仍有气泡就停止实验进行测量气体的体积
c.量气管中的食盐水不饱和
您最近一年使用:0次
名校
解题方法
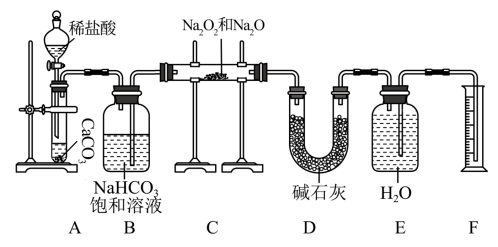
2 . 现有mg含有Na2O杂质的Na2O2样品,某同学在实验室用如下装置(部分夹持仪器已省略)测定其杂质含量:
回答下列问题:
(1)装置A中反应的离子方程式为___________ ;该反应基本类型为___________ ,其中CaCO3属于___________ (填“酸”“碱”或“盐”)。
(2)图中有一处明显错误,请指出并改正:___________ 。
(3)装置B的作用是___________ ;装置D的作用是___________ ;若无装置D,样品中杂质的质量分数___________ (填“偏高”“偏低”或“无影响”)。
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:___________ 。
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为___________ (用含m、V的代数式表示,列出计算式即可)。

回答下列问题:
(1)装置A中反应的离子方程式为
(2)图中有一处明显错误,请指出并改正:
(3)装置B的作用是
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为
您最近一年使用:0次
2022-01-18更新
|
110次组卷
|
2卷引用:内蒙古乌兰浩特第一中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
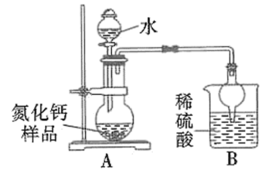
3 . 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是_______ 。
(2)装置A中每生成标准状况下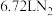 ,转移的电子数为
,转移的电子数为_______ 。
(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为_______ 。
(4)设计实验证明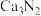 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:_______ 。
II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。
①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是
(2)装置A中每生成标准状况下
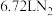 ,转移的电子数为
,转移的电子数为(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为
(4)设计实验证明
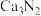 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。

①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
2021-09-16更新
|
255次组卷
|
3卷引用:内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题
解题方法
4 . 在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是___________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是_______________________________________________ 。
乙同学认为是O2,其可能的理由是______________________________________________ 。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_________________ 。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为________________________________________ 。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为________ mol·L-1;铁钉中单质铁的质量分数为____________ 。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是
乙同学认为是O2,其可能的理由是
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 两投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
所配硫酸的物质的量浓度为
您最近一年使用:0次
2020-09-22更新
|
104次组卷
|
2卷引用:内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题
名校
解题方法
5 . I.碳、硫的含量对钢铁性能影响很大,其含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。实验流程如图:
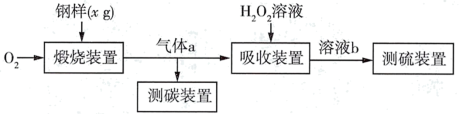
(1)煅烧装置中采用纯氧,目的是_______ 。气体a的主要成分有_____ 、CO2和未反应的O2。
(2)为充分吸收气体a,下列吸收装置中合适的是______ (填标号)。
A.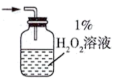 B.
B.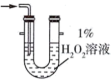
C. D.
D.
(3)气体a被 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。
①滴定时 溶液置于
溶液置于_____ (填仪器名称)中,若以酚酞为指示剂,终点时的现象为_______ 。
②若称取1 g钢样进行实验,滴定消耗 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为_____ 。
(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。
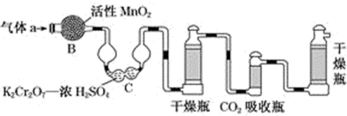
①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是______ 。
②计算钢样中碳的质量分数,应测量的数据是_______ 。
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是______ (填标号)
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为________ 。
(2)电弧炉中生成粗硅,反应的化学方程式为_______ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为___________ 。

(1)煅烧装置中采用纯氧,目的是
(2)为充分吸收气体a,下列吸收装置中合适的是
A.
 B.
B.
C.
 D.
D.
(3)气体a被
 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。①滴定时
 溶液置于
溶液置于②若称取1 g钢样进行实验,滴定消耗
 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。

①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是
②计算钢样中碳的质量分数,应测量的数据是
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为
(2)电弧炉中生成粗硅,反应的化学方程式为
您最近一年使用:0次
6 . 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
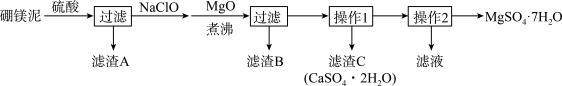
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___ 。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___ 。
(3)加入MgO后,加热煮沸的目的是___ 。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___ 。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___ 。
(6)获取MgSO4·7H2O的操作2为:___ 、___ 、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___ (能或不能),表达式(或理由)为___ 。

已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
| 温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(2)滤渣A中除含少量CaSO4·2H2O外,还有
(3)加入MgO后,加热煮沸的目的是
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止
(6)获取MgSO4·7H2O的操作2为:
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。
您最近一年使用:0次
2020-04-04更新
|
355次组卷
|
3卷引用:内蒙古呼伦贝尔市海拉尔区2020届高三上学期第一次模拟统一考试理科综合化学试题
7 . “84”消毒液是一种以 为主的高效消毒剂,被广泛用于宾馆、医院、食品加工行业、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图甲所示,该“84”消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
为主的高效消毒剂,被广泛用于宾馆、医院、食品加工行业、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图甲所示,该“84”消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
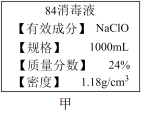
(1)此“84”消毒液的物质的量浓度约为_______  。(计算结果保留一位小数)
。(计算结果保留一位小数)
(2)某同学量取 此“84”消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中
此“84”消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中
_______  。
。
(3)该同学阅读该“84”消毒液的配方后,欲用 固体配制
固体配制 质量分数为24%的消毒液。
质量分数为24%的消毒液。
①如图乙所示的仪器中配制溶液不需要使用的是_______ (填序号),还缺少的玻璃仪器是_______ 。
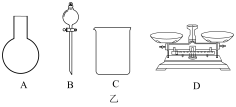
②下列操作中,容量瓶不具备的功能是_______ (填序号)。
a.配制一定体积准确浓度的标准溶液
b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液
d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
③请计算该同学配制此溶液需用托盘天平称取 固体的质量为
固体的质量为_______ g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是_______(填序号)。
 为主的高效消毒剂,被广泛用于宾馆、医院、食品加工行业、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图甲所示,该“84”消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
为主的高效消毒剂,被广泛用于宾馆、医院、食品加工行业、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图甲所示,该“84”消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
(1)此“84”消毒液的物质的量浓度约为
 。(计算结果保留一位小数)
。(计算结果保留一位小数)(2)某同学量取
 此“84”消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中
此“84”消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中
 。
。(3)该同学阅读该“84”消毒液的配方后,欲用
 固体配制
固体配制 质量分数为24%的消毒液。
质量分数为24%的消毒液。①如图乙所示的仪器中配制溶液不需要使用的是

②下列操作中,容量瓶不具备的功能是
a.配制一定体积准确浓度的标准溶液
b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液
d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
③请计算该同学配制此溶液需用托盘天平称取
 固体的质量为
固体的质量为(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是_______(填序号)。
| A.定容时仰视刻度线 | B.转移前,容量瓶内有蒸馏水 |
| C.未冷却至室温就转移定容 | D.定容时加水过量,用胶头滴管吸出 |
您最近一年使用:0次
8 . 氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:_______ ;已知浓盐酸的质量分数为36.5%,密度为1.15g/mL,则该浓盐酸的物质的量浓度是_______ ;浓盐酸起酸性作用和还原剂作用的物质的量之比为_______ 。
②选择装置,将各仪器按先后顺序连接起来,应该是a→_______ →h(用导管口处的字母表示)。
(2)装置C中饱和食盐水的作用是_______ 。
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:_______ ,实验结束后检验E中溶液含有氯离子的实验操作是_______ 。
(4)该小组同学设计并分别利用图2所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。G中的现象是_______ ,原因是_______ (用化学方程式表示)。


(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:
②选择装置,将各仪器按先后顺序连接起来,应该是a→
(2)装置C中饱和食盐水的作用是
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:
(4)该小组同学设计并分别利用图2所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。G中的现象是

您最近一年使用:0次
9 . 氯化钠是一种重要的食品添加剂与工业原料,自春秋时期,齐国管仲就提出了“官山海”政策,即对盐实行专卖。秦国商鞅变法,控制山泽之利,也实行食盐专卖。
(1)实验室现需要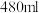

 溶液,配制时使用容量瓶的规格为
溶液,配制时使用容量瓶的规格为___________ ;下列操作会使所配溶液浓度偏低的是___________ (填标号)。
a.容量瓶洗涤干净后未放入加热烘箱干燥
b.定容、摇匀后发现液面下降,再加适量的蒸馏水
c.在定容时俯视容量瓶上的刻度线
d.初次转移溶液后,未洗涤烧杯和玻璃棒
(2)粗盐中常含有少量的 Ca2+、Mg2+、 等杂质离子,可采用如图的工序来纯化。
等杂质离子,可采用如图的工序来纯化。___________ 、___________ 的方法。
②试剂a中包含多种物质,按滴加顺序依次是NaOH、___________ 、___________ (填化学式)。要在实验室中完成“过滤”操作,需要的玻璃仪器包括烧杯、玻璃棒、___________ 。
③要检验产品中是否存在 ,需要进行的操作是
,需要进行的操作是___________ 。
④某工厂因工艺不佳,其最终的产品中混入了少量的FeCl3,已知FeCl3与 Na2EDTA可发生反应 (产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是
(产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是___________ (保留两位有效数字)。
(1)实验室现需要
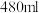

 溶液,配制时使用容量瓶的规格为
溶液,配制时使用容量瓶的规格为a.容量瓶洗涤干净后未放入加热烘箱干燥
b.定容、摇匀后发现液面下降,再加适量的蒸馏水
c.在定容时俯视容量瓶上的刻度线
d.初次转移溶液后,未洗涤烧杯和玻璃棒
(2)粗盐中常含有少量的 Ca2+、Mg2+、
 等杂质离子,可采用如图的工序来纯化。
等杂质离子,可采用如图的工序来纯化。
②试剂a中包含多种物质,按滴加顺序依次是NaOH、
③要检验产品中是否存在
 ,需要进行的操作是
,需要进行的操作是④某工厂因工艺不佳,其最终的产品中混入了少量的FeCl3,已知FeCl3与 Na2EDTA可发生反应
 (产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是
(产品中其他物质不与Na2EDTA反应),若质量监督管理人员在实验中称取5.000 g产品,测试发现恰好能与20.00 ml 0.01 mol/L Na2EDTA溶液完全反应,则产品中FeCl3的质量分数是
您最近一年使用:0次
10 . 实验室需要0.1 mol⋅L NaOH溶液450 mL和0.5 mol⋅L
NaOH溶液450 mL和0.5 mol⋅L 硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________ (填字母)。仪器C的名称是___________ ,本实验所需玻璃仪器E的规格和名称是___________ 。___________ (填“大于”“等于”或“小于”,下同)0.1 mol⋅L 。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度
。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度___________ 0.1 mol⋅L 。
。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g⋅cm 的浓硫酸的体积为
的浓硫酸的体积为___________ mL(计算结果保留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用___________ mL规格的量筒最好。
(4)如果定容时不小心超过刻度线,应如何操作:___________ 。
 NaOH溶液450 mL和0.5 mol⋅L
NaOH溶液450 mL和0.5 mol⋅L 硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是
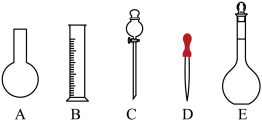
 。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度
。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 。
。(3)根据计算得知,所需质量分数为98%、密度为1.84 g⋅cm
 的浓硫酸的体积为
的浓硫酸的体积为(4)如果定容时不小心超过刻度线,应如何操作:
您最近一年使用:0次



