名校
1 . 现将10.6gNa2CO3固体溶于水配成体积为1L的溶液,回答下列问题:
(1)该溶液中Na+的浓度是___________ mol∙L−1,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol·L-1(假设溶液体积不变)需加入NaCl的质量为___________
(2)现有某浓度的浓盐酸,该盐酸的密度d=1.2g/cm3,质量分数w = 36.5%,计算该盐酸的物质的量浓度是___________ mol/L。
(3)欲将题干中的Na2CO3完全反应生成CO2气体,则至少需要(2)中的盐酸___________ mL,生成的CO2气体的体积是___________ mL (标况下)。
(1)该溶液中Na+的浓度是
(2)现有某浓度的浓盐酸,该盐酸的密度d=1.2g/cm3,质量分数w = 36.5%,计算该盐酸的物质的量浓度是
(3)欲将题干中的Na2CO3完全反应生成CO2气体,则至少需要(2)中的盐酸
您最近一年使用:0次
2021-07-28更新
|
1178次组卷
|
5卷引用:内蒙古杭锦后旗奋斗中学2020-2021学年高一上学期期中考试化学试题
内蒙古杭锦后旗奋斗中学2020-2021学年高一上学期期中考试化学试题(已下线)专题2.3.3 物质的量浓度(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)1.3.3 物质的量浓度(包括稀释、混合溶液的计算)-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)第二章 海水中的重要元素——钠和氯(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)第3课时 物质的量浓度
2 . 铝镁合金是飞机制造、化工生产等行业的重要材料。某研究性学习小组为测定某铝镁合金(不含其他元素)中铝的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的离子方程式是___ 。
[实验步骤]
(2)称取8.1g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥___ mL。
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将___ (填“偏高”、“偏低”或“无影响”)。
[方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(4)同学们拟选用下列实验装置完成实验:
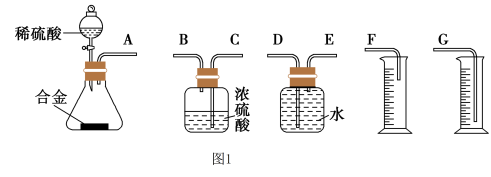
你认为最简易的装置其连接顺序是A接( ),( )接( ),( )接( )(填接口字母,注意:可不填满)___ 。
(5)仔细分析上述实验装置后,同学们认为会引起较大误差。于是他们设计了如图2所示的实验装置。与图2装置相比,用图1连接的装置进行实验时,若不考虑导管中液体体积的影响,测定铝镁合金中铝的质量分数将___ (填“偏大”、“偏小”或“无影响”).
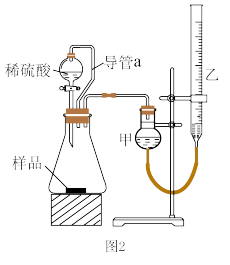
某同学提出该实验装置不够完善,应在甲和锥形瓶之间添加一个装有碱石灰的干燥装置。你的意见是___ (填“需要”或“不需要”)
(6)用图2装置进行实验时:为了较准确测量氢气的体积,在读反应前后量气管乙中液面的读数求其差值的过程中,应注意___(填字母编号)。
(7)图2装置进行实验,合金的质量为7.8g,测得氢气体积为8.96L(标准状况),则合金中铝的质量分数为___ (保留两位有效数字)。
[方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的离子方程式是
[实验步骤]
(2)称取8.1g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将
[方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(4)同学们拟选用下列实验装置完成实验:

你认为最简易的装置其连接顺序是A接( ),( )接( ),( )接( )(填接口字母,注意:可不填满)
(5)仔细分析上述实验装置后,同学们认为会引起较大误差。于是他们设计了如图2所示的实验装置。与图2装置相比,用图1连接的装置进行实验时,若不考虑导管中液体体积的影响,测定铝镁合金中铝的质量分数将

某同学提出该实验装置不够完善,应在甲和锥形瓶之间添加一个装有碱石灰的干燥装置。你的意见是
(6)用图2装置进行实验时:为了较准确测量氢气的体积,在读反应前后量气管乙中液面的读数求其差值的过程中,应注意___(填字母编号)。
| A.冷却至室温 |
| B.等待片刻,待乙管中液面不再上升时立即读数 |
| C.读数时应移动右侧量气管,使甲乙两端液面相平 |
| D.视线与凹液面最低处相平 |
您最近一年使用:0次
名校
解题方法
3 . 有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)等质量的O2和O3所含分子个数比为________ ,所含原子个数比为_______ 。
(2)设NA为阿伏加 德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________ (用含NA的式子表示)。
(3)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为__________ 。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______ mol/L。
(5)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后(溶液体积保持不变),溶液中SO42-的物质的量浓度为____________ 。
(1)等质量的O2和O3所含分子个数比为
(2)设NA为阿伏加 德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是
(3)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为
(5)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后(溶液体积保持不变),溶液中SO42-的物质的量浓度为
您最近一年使用:0次
解题方法
4 . 在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl。
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5L•mol-1)则:
(1)反应生成HCl气体的质量为__ ,转移电子的总数为___ 。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g•mL-1的盐酸,此盐酸的物质的量浓度为___ 。
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为___ 。纯净的石英与烧碱反应可以制得水玻璃,反应的离子方程式为__ 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是___ t。(保留两位小数)
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5L•mol-1)则:
(1)反应生成HCl气体的质量为
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g•mL-1的盐酸,此盐酸的物质的量浓度为
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是
您最近一年使用:0次
名校
5 . O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为____ ,原子个数比为_____ ,分子的物质的量之比为____ 。
(2)等温等压下,等体积的O2和O3所含分子个数比为___ ,原子个数比为_____ ,质量比为___ 。
(3)设NA为阿伏加 德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__ (用含NA的式子表示)。
(4)配制100 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为____ mL。
(1)等质量的O2和O3所含分子个数比为
(2)等温等压下,等体积的O2和O3所含分子个数比为
(3)设NA为阿伏加 德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是
(4)配制100 mL 1 mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为
您最近一年使用:0次
2019-10-16更新
|
124次组卷
|
6卷引用:内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高一上学期期中考试化学试题
名校
6 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___ 、___ 。
(2)取出这种盐酸100mL,稀释至1.18L,所得稀盐酸的物质的量浓度是_____ 。
(3)将不纯的NaOH样品4g(样品含少量Na2CO3和水),放入50mL2mol·L﹣1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40mL1mol·L﹣1的NaOH溶液.蒸发中和后的溶液,最终得到__ 克固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取出这种盐酸100mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)将不纯的NaOH样品4g(样品含少量Na2CO3和水),放入50mL2mol·L﹣1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40mL1mol·L﹣1的NaOH溶液.蒸发中和后的溶液,最终得到
您最近一年使用:0次
2019-10-12更新
|
195次组卷
|
3卷引用:内蒙古赤峰二中人教版高中化学必修1练习:化学计量及其应用(2)
名校
7 . (1)48g氧气和48g臭氧(O3),它们所含的原子数_______ (填“相同”或“不同”,它们在同温同压下的体积比是________ 。0.2 mol NH3分子与________ 个CH4含有的电子数相同,与_______ g H2O含有的氢原子数相同,与标准状况下____ L CO含有的原子数相等。
(2)483g Na2SO4·10H2O中所含的Na2SO4·10H2O的物质的量是_______ ; Na2SO4·10H2O的摩尔质量是________ ,所含Na+的物质的量是________ 。含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是________ 。
(3)实验室常用的浓盐酸密度为1.17 g·mL-1,质量分数为36.5 %。
①此浓盐酸的物质的量浓度为__________________ 。
②取此浓盐酸50mL,用蒸馏水稀释为200mL,稀释后盐酸的物质的量浓度为_____ 。
(2)483g Na2SO4·10H2O中所含的Na2SO4·10H2O的物质的量是
(3)实验室常用的浓盐酸密度为1.17 g·mL-1,质量分数为36.5 %。
①此浓盐酸的物质的量浓度为
②取此浓盐酸50mL,用蒸馏水稀释为200mL,稀释后盐酸的物质的量浓度为
您最近一年使用:0次
名校
8 . (1)在标准状况下①6.72L CH4②3.01×1023个HCl分子③ 13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是_____
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为________ mol, CO占总体积的______ (保留一位小数),混合气体的摩尔质量为_______ (保留一位小数)。
(3)某混合气体中各气体的质量分数为:O232%,N228%,CO222%,CH416%,H22%,则此混合气体的平均摩尔质量为______ (保留两位小数)。
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为
(3)某混合气体中各气体的质量分数为:O232%,N228%,CO222%,CH416%,H22%,则此混合气体的平均摩尔质量为
您最近一年使用:0次
名校
9 .
(1)等质量的NO2和N2O4所含分子个数比为_______ ,氧原子个数比为______ ,bgNO2和N2O4的混合物中氮元素的质量分数为__________ 。(保留一位小数)
(2)等温等压下,等体积的O2和O3所含分子个数比为________ ,质子数之比为________ ,质量比为________ 。
(1)等质量的NO2和N2O4所含分子个数比为
(2)等温等压下,等体积的O2和O3所含分子个数比为
您最近一年使用:0次
10 . 把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算(写出计算过程):
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
您最近一年使用:0次
2016-12-09更新
|
287次组卷
|
4卷引用:2015-2016学年内蒙古赤峰市宁城县高一上学期期末考试化学试卷



