广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
广西
高三
期中
2022-10-11
178次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学实验基础、化学反应原理
广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
广西
高三
期中
2022-10-11
178次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学实验基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A.铁粉和碳粉的混合物可作食品抗氧化剂 |
| B.共享单车利用太阳能发电完成卫星定位,有利于节能环保 |
| C.补铁剂与维生素C共同服用可提高补铁效果 |
| D.光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品 |
您最近一年使用:0次
2018-05-02更新
|
282次组卷
|
6卷引用:西藏自治区拉萨中学2018届高三第七次月考理综化学试题
单选题
|
适中(0.65)
名校
2. 设NA为阿伏伽德罗常数的数值。下列有关叙述正确的是
| A.7.8gNa2O2中阴离子所含的电子数为1.8NA |
| B.标准状况下,22.4LCCl4中所含C—C1键的数目为4NA |
| C.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| D.在11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6mol CuSO4能氧化白磷的分子数为1.1NA |
【知识点】 阿伏加德罗常数的求算解读
您最近一年使用:0次
2018-05-02更新
|
129次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三第七次月考理综化学试题
单选题
|
适中(0.65)
解题方法
3. 下列三种有机物是某些药物中的有效成分:

以下说法不正确的是

以下说法不正确的是
| A.三种有机物都属于芳香族化合物 |
| B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| C.将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多 |
| D.三种有机物中只有一种能与浓溴水发生化学反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
4. X、Y、Z、R均是短周期主族元素,X元素的一种核素可用于考古断代,Y元素原子中最外层电子数是次外层电子数的三倍,Z元素化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
| A.简单氢化物的沸点: Y >R |
| B.原子半径的大小顺序:Z>R>X>Y |
| C.氧化物对应的水化物的酸性:R >X |
| D.只含有Y、Z、R三种元素的化合物一定既含离子键又含共价键 |
您最近一年使用:0次
2017-05-18更新
|
203次组卷
|
2卷引用:贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题
5. 如图,下列实验不能达到相应实验目的的是
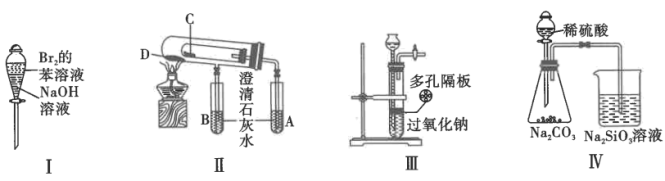

| A.装置I可以用来除去苯中的溴 |
B.装置II验证碳酸钠和碳酸氢钠的稳定性时C中盛 ,D中盛 ,D中盛 |
| C.装置III可用于实验室制备少量氧气 |
D.装置IV能证明非金属性: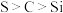 |
您最近一年使用:0次
2021-09-16更新
|
505次组卷
|
3卷引用:云南省云南师范大学第二附属中学2022届高三8月理综试卷化学试题
云南省云南师范大学第二附属中学2022届高三8月理综试卷化学试题(已下线)第三单元 金属及其化合物(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
单选题
|
较难(0.4)
名校
6. 截至2016年年底,中国光伏发电新增装机容量达到34.54GW,光伏发电累计装机容量达到77.42GW,图1为光伏并网发电装置。图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是
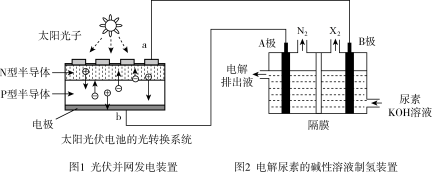

| A.图1中N型半导体为正极,P型半导体为负极 |
| B.图2溶液中电子流向:从B极流向A极 |
| C.X2为氧气 |
| D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-===CO32-+N2↑+6H2O |
您最近一年使用:0次
2019-02-19更新
|
240次组卷
|
12卷引用:2017届河北沧州市第一中学高三上学期第一次月考化学试题
2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河北省衡水中学高三上期中化学卷2016-2017学年江西省吉安一中高二上段考二化学试卷2016-2017学年安徽省淮北市第一中学高二下学期第一次月考化学试卷贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题福建省福州市闽侯县2016-2017学年高二下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2018届高三上学期期中考试化学试题江西省师范大学附属中学2019届高三上学期期末考试化学试题山西省运城市芮城县2018-2019学年高二上学期期末考试化学试题(已下线)湖北省宜昌市葛洲坝中学2018-2019学年高二上学期期末考试化学试题湖南省株洲市九方中学2022届高三下学期4月月考化学试题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
单选题
|
适中(0.65)
名校
7. 常温下,向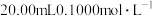 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中
溶液,溶液中 随
随 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是

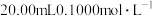 的
的 溶液中滴加
溶液中滴加 的
的 溶液,溶液中
溶液,溶液中 随
随 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
A.常温下, 的电离平衡常数为 的电离平衡常数为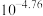 |
B. 时,消耗 时,消耗 溶液的体积小于 溶液的体积小于 |
C.溶液中水的电离程度大小: |
D.c点溶液中 |
您最近一年使用:0次
2021-09-16更新
|
263次组卷
|
4卷引用:云南省云南师范大学第二附属中学2022届高三8月理综试卷化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
8. 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是_______ 。
(2)装置A中每生成标准状况下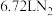 ,转移的电子数为
,转移的电子数为_______ 。
(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为_______ 。
(4)设计实验证明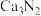 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:_______ 。
II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。
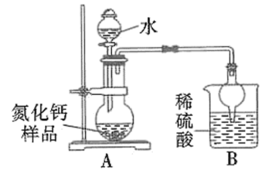
①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是
(2)装置A中每生成标准状况下
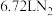 ,转移的电子数为
,转移的电子数为(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为
(4)设计实验证明
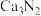 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。

①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
2021-09-16更新
|
255次组卷
|
3卷引用:云南省云南师范大学第二附属中学2022届高三8月理综试卷化学试题
解答题-原理综合题
|
适中(0.65)
9. 工业上可用合成气(主要成分为CO2、H2、CO)在催化剂作用下合成甲醇,并可用甲醇合成甲醚。
(1)CO2 的电子式是_______ 。
(2)已知:CO(g)+2H2(g) CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol
CO2 (g) + H2 (g) CO(g) + H2O(g) △H2 = +41.19 kJ/mol
CO(g) + H2O(g) △H2 = +41.19 kJ/mol
则CO2与H2反应制备CH3OH (g) 的热化学方程式是_______ 。
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。
(注:T5时,H2转化率为66.67%,即转化了 )
)
① 催化剂效果最佳的反应是_______ (填“I”“ Ⅱ”或“Ⅲ”)。
② T3 时,反应I的v(正)_______ v(逆)(填“>”“<”或“=”)。
③ 温度为T5 时,该反应的平衡常数K=_______ 。
(4)甲醇合成甲醚的反应为2CH3OH(g) CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
反应过程中存在副反应2CH3OH(g) C2H4(g)+2H2O(g)。
C2H4(g)+2H2O(g)。
反应过程中的能量变化如图所示:

①反应速率较快的是_______ (填“Ⅰ”或“Ⅱ”),原因是_______ 。
②根据反应原理,分析增大压强对合成甲醚的影响_______ 。
(1)CO2 的电子式是
(2)已知:CO(g)+2H2(g)
 CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol CO2 (g) + H2 (g)
 CO(g) + H2O(g) △H2 = +41.19 kJ/mol
CO(g) + H2O(g) △H2 = +41.19 kJ/mol 则CO2与H2反应制备CH3OH (g) 的热化学方程式是
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。
| 温度 转化率 反应 | T1 | T2 | T3 | T4 | T5 |
| Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
 )
)① 催化剂效果最佳的反应是
② T3 时,反应I的v(正)
③ 温度为T5 时,该反应的平衡常数K=
(4)甲醇合成甲醚的反应为2CH3OH(g)
 CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
 C2H4(g)+2H2O(g)。
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:

①反应速率较快的是
②根据反应原理,分析增大压强对合成甲醚的影响
【知识点】 盖斯定律与热化学方程式解读 化学平衡的移动及其影响因素
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
10. 氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:

已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)= 2×10-7,2Cu+= Cu+Cu2+的平衡常数K1= 1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有_______ (填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98% H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______ 。“酸浸”时硫酸不宜过多的原因是_______ 。
(3)加热“蒸氨”在减压条件下进行的原因是_______ 。
(4)X 可以充分利用流程中的产物,若X 是SO2时,通入CuCl2溶液中反应的离子方程式是_______ ;若X 是Cu时,反应Cu+Cu2++2Cl-= 2CuCl 的平衡常数K2=_______ 。
(5)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式_______ 。

已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)= 2×10-7,2Cu+= Cu+Cu2+的平衡常数K1= 1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有
(2)“酸浸”所需H2SO4是用等体积的98% H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有
(3)加热“蒸氨”在减压条件下进行的原因是
(4)X 可以充分利用流程中的产物,若X 是SO2时,通入CuCl2溶液中反应的离子方程式是
(5)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较难(0.4)
名校
11. 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
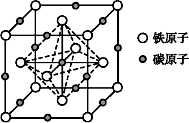
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

您最近一年使用:0次
2017-02-24更新
|
2503次组卷
|
11卷引用:2017届安徽省A10联盟高三下学期开年考试理综化学试卷
2017届安徽省A10联盟高三下学期开年考试理综化学试卷2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷江西省上饶市重点中学2018届高三六校第一次联考理综化学试题吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题2020年全国卷Ⅰ理综化学高考真题变式题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
四、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 苯是工业上常用的化工原料,可以用于合成安息香酸苄酯和高分化合物G (部分反应条件略去),流程如下所示,请回答下列问题:
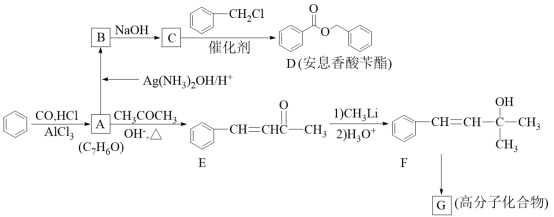
(1)C的化学名称是____________ ,B中的官能团名称是____________ 。
(2)E分子中最多有____________ 个原子共平面;G的结构简式为____________ ;
(3)C生成D的反应类型为____________ 。
(4)A生成E的化学方程式为_____________________________________ 。
(5)H是D的同分异构体,分子中含有酯基,有两个苯环且不直接相连,符合上述条件的结构有____________ 种,其中核磁共振氢谱图有6组峰,且面积比为3∶2∶2∶2∶2∶1的同分异构体的结构简式为____________ (写出一种即可)。
(6)参照上述合成路线,以2-氯丙烷为原料,其它无机试剂和有机溶剂任选,设计2-甲基-2-丙醇的合成路线____________ 。

(1)C的化学名称是
(2)E分子中最多有
(3)C生成D的反应类型为
(4)A生成E的化学方程式为
(5)H是D的同分异构体,分子中含有酯基,有两个苯环且不直接相连,符合上述条件的结构有
(6)参照上述合成路线,以2-氯丙烷为原料,其它无机试剂和有机溶剂任选,设计2-甲基-2-丙醇的合成路线
您最近一年使用:0次
2017-04-20更新
|
499次组卷
|
5卷引用:广东省佛山市2017届高三4月教学质量检测(二)理综化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学实验基础、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化学科学对人类文明发展的意义 食品添加剂 药物的合理使用 | |
| 2 | 0.65 | 阿伏加德罗常数的求算 | |
| 3 | 0.65 | 同分异构体的数目的确定 芳香族化合物的区别与分类 含有酚羟基的物质性质的推断 含酯基有机物水解消耗NaOH的量的计算 | |
| 4 | 0.65 | 由元素性质的递变规律进行相关推断 根据原子结构进行元素种类推断 | |
| 5 | 0.65 | 过氧化钠与水的反应 碳酸钠与碳酸氢钠性质的比较 元素金属性、非金属性强弱探究实验 萃取和分液 | |
| 6 | 0.4 | 根据电解产物进行相关推断 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.65 | 影响水电离的因素 弱电解质的电离平衡 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应有关计算 常用仪器及使用 物质分离、提纯综合应用 物质制备的探究 | 实验探究题 |
| 9 | 0.65 | 盖斯定律与热化学方程式 化学平衡的移动及其影响因素 | 原理综合题 |
| 10 | 0.65 | 氨的物理性质 含硫化合物之间的转化 溶度积常数相关计算 配制一定物质的量浓度的溶液实验的仪器 | 工业流程题 |
| 12 | 0.65 | 同分异构体的数目的确定 有机分子中原子共面的判断 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |
| 三、填空题 | |||
| 11 | 0.4 | 物质结构与性质综合考查 共价键概念及判断 核外电子能级分布 电子排布式 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 配合物的结构与性质 晶格能 常见离子晶体的结构 | |



