贵州省遵义市第六中学2017届高三5月月考理综合化学试卷
贵州
高三
阶段练习
2017-05-26
308次
整体难度:
适中
考查范围:
有机化学基础、认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础
贵州省遵义市第六中学2017届高三5月月考理综合化学试卷
贵州
高三
阶段练习
2017-05-26
308次
整体难度:
适中
考查范围:
有机化学基础、认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 化学与生产、生活、社会发展等息息相关。下列说法正确的是
| A.为补充土壤中的钾元素,可在田间焚烧秸秆 |
| B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 |
| C.石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 |
| D.做衣服的棉和麻灼烧有烧焦羽毛的气味 |
【知识点】 糖类的燃烧
您最近一年使用:0次
2017-05-18更新
|
263次组卷
|
2卷引用:贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题
二、未知 添加题型下试题
未知-未知
|
适中(0.65)
2. 某有机物分子式为C4H8,下列有关说法正确的是
| A.其一氯代物可能只有一种 |
| B.其分子中的共面原子最多6个 |
| C.可用催化加氢反应除去C4H10中的C4H8 |
| D.等质量的CH4和C4H8分别在氧气中完全燃烧,耗氧量CH4少于C4H8 |
您最近一年使用:0次
2017-08-04更新
|
253次组卷
|
2卷引用:2017届广西桂林市、崇左市、百色市高三第一次联合模拟考试化学试卷
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
3. 以淀粉为基本原料可制备许多物质,如:
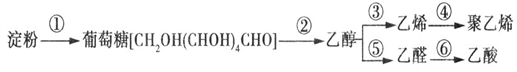
下列有关说法中正确的是( )
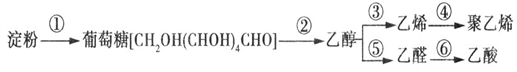
下列有关说法中正确的是( )
| A.淀粉是糖类物质,有甜味,与纤维素互为同分异构体 |
| B.反应③是消去反应、反应④是加聚反应、反应⑤是取代反应 |
| C.乙烯、聚乙烯分子中均含有碳碳双键,均可被酸性KMnO4溶液氧化 |
| D.在加热条件下,可用银氨溶液将鉴别葡萄糖和乙醇 |
【知识点】 淀粉、纤维素的水解
您最近一年使用:0次
2017-05-18更新
|
381次组卷
|
3卷引用:贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题
四、未知 添加题型下试题
未知-未知
|
适中(0.65)
4. 向3mol·L-1盐酸中加入打磨后的镁条,一段时间后生成灰白色固体X,并测得反应后溶液pH升高。为确认固体X的成分,过滤洗涤后进行实验:
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b。下列分析不正确 的是( )
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b。下列分析
| A.溶液pH升高的主要原因:Mg + 2H+ === Mg2+ + H2↑ |
| B.生成沉淀a的离子方程式:Ag+ + Cl- === AgCl↓ |
| C.沉淀b是Mg(OH)2 |
| D.若a、b的物质的量关系为n(a):n(b) = 1:3,则可推知固体X的化学式为Mg3(OH)6Cl |
您最近一年使用:0次
五、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
5. 下列关于图中各装置的叙述不正确的是
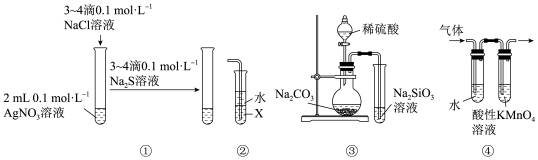

| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②中若X为四氯化碳,则该装置可用于吸收氨气,并防止发生倒吸 |
| C.装置③的实验可推断硫、碳、硅三种元素的非金属性强弱 |
| D.装置④可检验溴乙烷发生消去反应得到的气体中含有乙烯 |
您最近一年使用:0次
2016-12-09更新
|
698次组卷
|
4卷引用:2011届北京市东城区高三第一学期期末考试化学试卷
(已下线)2011届北京市东城区高三第一学期期末考试化学试卷贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题贵州省遵义市第六中学2017届高三5月月考理综合化学试卷天津市第四十七中学2020~2021学年高三模拟考试化学试题
单选题
|
适中(0.65)
名校
6. 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4–和有机阳离子构成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是


| A.放电时,铝为负极、石墨为正极 |
| B.放电时,有机阳离子向铝电极方向移动 |
| C.放电时的负极反应为:Al –3e-+ 7AlCl4-= 4Al2Cl7- |
| D.充电时的阳极反应为:Cn+ AlCl4-–e- = CnAlCl4 |
【知识点】 二次电池
您最近一年使用:0次
2016-12-09更新
|
440次组卷
|
6卷引用:2016届北京市海淀区高三上学期期末考试化学试卷
单选题
|
适中(0.65)
名校
7. 25℃时,下列有关说法正确的是
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7 |
| B.0.1 mol·L-1 NH4Cl 溶液与 0.1 mol·L-1 氨水等体积混合(pH>7):c(NH3 ·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| C.向 0.10 mol·L-1Na2SO3溶液中通 SO2 气体至溶液 pH=7:c(Na+) = 2c(SO32-)+c(HSO3-) |
| D.0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液 c(Cl-)=c(Br-) |
您最近一年使用:0次
2017-05-18更新
|
303次组卷
|
3卷引用:贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题
六、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
8. ICl( 一氯化碘,沸点97.4℃),是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题:
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备ICl,其装置如下:(已知碘与氯气的反应为放热反应)

①各装置连接顺序为A→________ ;A装置中发生反应的离子方程式为__________ 。
②B装置烧瓶需放在冷水中,其目的是:__________ ,D装置的作用是____________ 。
③将B装置得到的液态产物进一提纯可得到较纯净的ICl,则提纯采取的操作方法是______ 。
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控 制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为________________ 。
(3)设计实验证明:
①ICl的氧化性比I2强:____________________________________________________ 。
②ICl与乙烯作用发生加成反应:____________________________________________ 。
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备ICl,其装置如下:(已知碘与氯气的反应为放热反应)

①各装置连接顺序为A→
②B装置烧瓶需放在冷水中,其目的是:
③将B装置得到的液态产物进一提纯可得到较纯净的ICl,则提纯采取的操作方法是
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控 制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为
(3)设计实验证明:
①ICl的氧化性比I2强:
②ICl与乙烯作用发生加成反应:
您最近一年使用:0次
2017-03-24更新
|
932次组卷
|
4卷引用:河北省衡水中学2017届高三下学期三调考试理科综合化学试题
七、填空题 添加题型下试题
填空题
|
较难(0.4)
名校
9. NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g) 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是_________ 。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O) 时,说明反应已达平衡
C.当容器内 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.当测得容器内的O2密度不再变化时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
① 该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2 4NO(g) +6H2O(g)的平衡常数K=
4NO(g) +6H2O(g)的平衡常数K=__________ ( 不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有______________
A.使用催化剂Cu/TiO2 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图:
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)______ c(NO3﹣)(填“>”、“<”或“=”).
②Ir﹣Ru惰性电极有吸附O2作用,该电极上的反应为______ .
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为______ .
反应I:4NH3(g) +5O2(g)
 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1反应 II:4NH3(g)+3O2(g)
 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H (1)
| 化 学 键 | H—O | O=O | N≡N | N—H |
| 键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=
(2)在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O) 时,说明反应已达平衡
C.当容器内
 =1时,说明反应已达平衡
=1时,说明反应已达平衡D.当测得容器内的O2密度不再变化时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
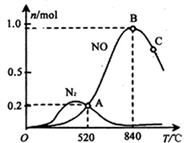
① 该催化剂在高温时选择反应
② 520℃时,4NH3(g)+5O2
 4NO(g) +6H2O(g)的平衡常数K=
4NO(g) +6H2O(g)的平衡常数K=③有利于提高NH3转化为N2平衡转化率的措施有
A.使用催化剂Cu/TiO2 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图:

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
②Ir﹣Ru惰性电极有吸附O2作用,该电极上的反应为
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为
【知识点】 化学平衡状态本质及特征解读
您最近一年使用:0次
2017-05-22更新
|
625次组卷
|
2卷引用:贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题
八、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
解题方法
10. 碳酸锂广泛应用于化工、冶金等行业。工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图:
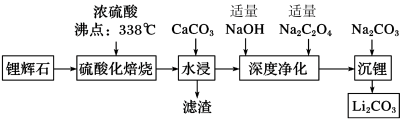
已知:碳酸锂的溶解度为((g/L)
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为_______ 。
(2)硫酸化焙烧温度控制在250℃﹣300℃之间,主要原因是_______ ;焙烧中硫酸用量控制在理论用量的l15%左右,硫酸加入过多的副作用是_______ 。
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有_______ 。
(4)“沉锂”的化学反应方程式为_______ 。
(5)“沉锂”需要在95℃以上进行,主要原因是_______ ,过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有_______ 和_______ 。

已知:碳酸锂的溶解度为((g/L)
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为
(2)硫酸化焙烧温度控制在250℃﹣300℃之间,主要原因是
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有
(4)“沉锂”的化学反应方程式为
(5)“沉锂”需要在95℃以上进行,主要原因是
【知识点】 硅酸盐组成的表示方法解读 氧化铝 物质制备的探究解读
您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
名校
解题方法
11. 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。
(1)基态Ti原子的价电子排布式为___________ 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____ 晶体,其电子式为______ 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为____ (标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为_____ ;列举与AlH4-空间构型相同的两种离子:_____ (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____ 个;NaAlH4晶体的密度为____ g/cm3(用含a 的代数式表示)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为___________ 。

(1)基态Ti原子的价电子排布式为
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为
(4)AlH4-中,Al的轨道杂化方式为
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
您最近一年使用:0次
2017-05-22更新
|
230次组卷
|
2卷引用:河北省衡水中学2017届高三下学期三调考试理科综合化学试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 苯是工业上常用的化工原料,可以用于合成安息香酸苄酯和高分化合物G (部分反应条件略去),流程如下所示,请回答下列问题:
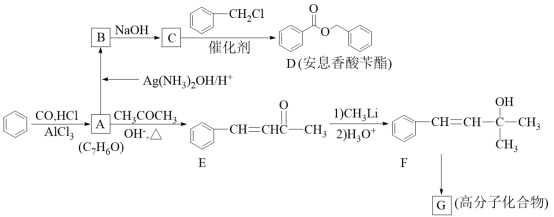
(1)C的化学名称是____________ ,B中的官能团名称是____________ 。
(2)E分子中最多有____________ 个原子共平面;G的结构简式为____________ ;
(3)C生成D的反应类型为____________ 。
(4)A生成E的化学方程式为_____________________________________ 。
(5)H是D的同分异构体,分子中含有酯基,有两个苯环且不直接相连,符合上述条件的结构有____________ 种,其中核磁共振氢谱图有6组峰,且面积比为3∶2∶2∶2∶2∶1的同分异构体的结构简式为____________ (写出一种即可)。
(6)参照上述合成路线,以2-氯丙烷为原料,其它无机试剂和有机溶剂任选,设计2-甲基-2-丙醇的合成路线____________ 。

(1)C的化学名称是
(2)E分子中最多有
(3)C生成D的反应类型为
(4)A生成E的化学方程式为
(5)H是D的同分异构体,分子中含有酯基,有两个苯环且不直接相连,符合上述条件的结构有
(6)参照上述合成路线,以2-氯丙烷为原料,其它无机试剂和有机溶剂任选,设计2-甲基-2-丙醇的合成路线
您最近一年使用:0次
2017-04-20更新
|
501次组卷
|
5卷引用:广东省佛山市2017届高三4月教学质量检测(二)理综化学试题
试卷分析
整体难度:适中
考查范围:有机化学基础、认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
5
未知
2
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 糖类的燃烧 | |
| 3 | 0.65 | 淀粉、纤维素的水解 | |
| 5 | 0.65 | 沉淀转化 溴乙烷的消去反应 元素金属性、非金属性强弱探究实验 化学实验方案的设计与评价 | |
| 6 | 0.65 | 二次电池 | |
| 7 | 0.65 | 溶度积规则及其应用 | |
| 二、未知 | |||
| 2 | 0.65 | 同分异构体的数目的确定 有机分子中原子共面的判断 利用烃完全燃烧耗氧量的规律进行的计算 | 未知 |
| 4 | 0.65 | 离子反应的实际应用 离子反应在化合物组成的分析、鉴定的应用 氯离子的检验 镁的结构与化学性质 | 未知 |
| 三、解答题 | |||
| 8 | 0.4 | 常见无机物的制备 | 实验探究题 |
| 10 | 0.65 | 硅酸盐组成的表示方法 氧化铝 物质制备的探究 | 工业流程题 |
| 11 | 0.4 | 价层电子对数的确定 利用杂化轨道理论判断分子的空间构型 配合物的结构与性质 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 同分异构体的数目的确定 有机分子中原子共面的判断 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |
| 四、填空题 | |||
| 9 | 0.4 | 化学平衡状态本质及特征 | |



