铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
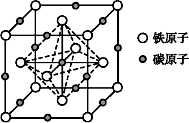
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

16-17高三下·安徽·开学考试 查看更多[11]
2017届安徽省A10联盟高三下学期开年考试理综化学试卷2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷江西省上饶市重点中学2018届高三六校第一次联考理综化学试题吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题2020年全国卷Ⅰ理综化学高考真题变式题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
更新时间:2017-02-24 16:48:08
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】氮化钠(Na3N)固体是一种重要的化合物,它与水反应可产生NH3。回答下列问题:
(1)Na3N属于________ (填“共价”或“离子”)化合物,Na3N的电子式为________ 。
(2)Na3N与足量盐酸反应的化学方程式为________ 。
(3)比较Na3N中两种粒子的半径:r(Na+)________ r(N3-)(填“>”“=”或“<”)。
(1)Na3N属于
(2)Na3N与足量盐酸反应的化学方程式为
(3)比较Na3N中两种粒子的半径:r(Na+)
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为______ 。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为______ ,1 mol该分子中含有的π键的数目为______ 。
(3)基态D原子的外围电子排布式为______ 。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于______ 晶体。
(4)已知元素E的氢化物的晶胞结构如图所示,则其化学式为______ 。

(1)元素A、B、C的第一电离能由小到大的顺序为
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为
(3)基态D原子的外围电子排布式为
(4)已知元素E的氢化物的晶胞结构如图所示,则其化学式为

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】2019年诺贝尔化学奖授予约翰•古德伊纳夫、斯坦利•惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为___ ,基态磷原子中,电子占据的最高能层符号为___ ,该能层能量最高的电子云在空间有___ 个伸展方向,原子轨道呈___ 形。
(2)[CO(NO )4]2-中Co2+的配位数为4,配体中N原子的杂化方式为
)4]2-中Co2+的配位数为4,配体中N原子的杂化方式为___ ,该配离子中各元素的第一电离能由小到大的顺序为___ (填元素符号),1mol该配离子中含σ键数目为___ NA。
(3)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为___ 键。NH3分子的空间构型为___ ,其中N原子的杂化轨道类型为___ 。
(4)钴蓝晶体结构如图,该立方晶胞由4个I型和4个II型小立方体构成,共化学式为___ ,晶体中Al3+占据O2-形成的___ (填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数得值,钴蓝晶体的密度为___ g•cm-3(列计算式)。

(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为
(2)[CO(NO
 )4]2-中Co2+的配位数为4,配体中N原子的杂化方式为
)4]2-中Co2+的配位数为4,配体中N原子的杂化方式为(3)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为
(4)钴蓝晶体结构如图,该立方晶胞由4个I型和4个II型小立方体构成,共化学式为

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:___________ ;
(2)写出氮气分子的结构式___________ 。
Ⅱ.下列物质:① N2 ② CO2 ③ NH3 ④ Na2O ⑤Na2O2 ⑥ NaOH ⑦ CaBr2 ⑧ H2O2 ⑨ NH4Cl ⑩ HBr。
(1)含有极性键和非极性键的是_______ ;
(2)含有非极性键的离子化合物是_____ 。(填序号,下同)
Ⅲ.下列变化中:① 干冰气化; ② 硝酸钾熔化; ③ KHSO4熔融; ④ 硫酸溶于水;
⑤ 蔗糖溶于水;⑥ HI分解; ⑦ 碘升华; ⑧ 溴蒸气被木炭吸附。
(1)未破坏化学键的是_____ ;
(2)仅离子键被破坏的是____ ;
(3)仅共价键被破坏的是____ 。
Ⅳ.下列物质:① 1H、2H、3H ; ② H2O、D2O、T2O; ③ O2、O3; ④ 14N、14C
(1)互为同位素的是:______ ;
(2)互为同素异形体的是:______ ;
(3)氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________ 种。
(1)写出二氧化碳分子的电子式:
(2)写出氮气分子的结构式
Ⅱ.下列物质:① N2 ② CO2 ③ NH3 ④ Na2O ⑤Na2O2 ⑥ NaOH ⑦ CaBr2 ⑧ H2O2 ⑨ NH4Cl ⑩ HBr。
(1)含有极性键和非极性键的是
(2)含有非极性键的离子化合物是
Ⅲ.下列变化中:① 干冰气化; ② 硝酸钾熔化; ③ KHSO4熔融; ④ 硫酸溶于水;
⑤ 蔗糖溶于水;⑥ HI分解; ⑦ 碘升华; ⑧ 溴蒸气被木炭吸附。
(1)未破坏化学键的是
(2)仅离子键被破坏的是
(3)仅共价键被破坏的是
Ⅳ.下列物质:① 1H、2H、3H ; ② H2O、D2O、T2O; ③ O2、O3; ④ 14N、14C
(1)互为同位素的是:
(2)互为同素异形体的是:
(3)氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】请回答下列与10电子和18电子微粒相关的问题:
(1) 18电子微粒中化学性质最稳定的_______ 。(填化学式)
(2) 18电子微粒中有一种强氧化性的四原子分子,该分子中含有的共价键种类是_______ ,物质保存时所用试剂瓶的种类与下列_______ (填选项字母)物质相同。
A.浓硝酸 B.碱石灰 C.氢氧化钠溶液 D.新制氯水
(3) 10电子微粒中有两种可以相互反应生成另外两种10电子微粒,产物中有一种是单核离子,该反应的方程式是_______
(4)10电子微粒中能使湿润的红色石蕊试纸变蓝的分子实验室制取时的收集方法是_______ 。
(5)10电子微粒中有一种能腐蚀玻璃,相关的化学方程式是_______ 。
(1) 18电子微粒中化学性质最稳定的
(2) 18电子微粒中有一种强氧化性的四原子分子,该分子中含有的共价键种类是
A.浓硝酸 B.碱石灰 C.氢氧化钠溶液 D.新制氯水
(3) 10电子微粒中有两种可以相互反应生成另外两种10电子微粒,产物中有一种是单核离子,该反应的方程式是
(4)10电子微粒中能使湿润的红色石蕊试纸变蓝的分子实验室制取时的收集方法是
(5)10电子微粒中有一种能腐蚀玻璃,相关的化学方程式是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金。Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
(1)Cu基态原子核外电子排布式为________________ 。
(2)1 mol Ni(CO)4中含有σ键的数目为_______________ 。
(3)[Cu(NH3)4]SO4中阴离子的空间构型是___________ ,与SO42-互为等电子体的分子为_______________ 。(填化学式)
(4) NH3的沸点_______________ 。(选填“高于”或“低于”)PH3,原因是_______________ 。
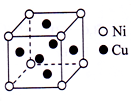
(5)某白铜合金晶胞结构如图所示.晶胞中铜原子与镍原子的个数比为_______________ 。
(1)Cu基态原子核外电子排布式为
(2)1 mol Ni(CO)4中含有σ键的数目为
(3)[Cu(NH3)4]SO4中阴离子的空间构型是
(4) NH3的沸点
(5)某白铜合金晶胞结构如图所示.晶胞中铜原子与镍原子的个数比为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为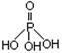 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为___________ 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为___________ 。
(2)氧原子核外有_____ 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式____________________________________________________________ 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________ 。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为___________ 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________ 。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。__________ 请完成并配平上述反应离子方程式。该反应的还原产物是__________ 。
 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。完成下列填空:
(1)磷元素原子核外最外层电子排布式为
(2)氧原子核外有
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_______________________ 。
(2)砷与氢元素可形成化合物砷化氢,该化合物的空间构型为_____________ ,其中砷原子的杂化方式为__________ 。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式________ 。
(4)已知由元素砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其中砷原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式____________ ;
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,通过计算确定铝原子在三维空间中堆积方式________________ (已知NA=6.02×1023,1pm=10-10cm,4053=6.64×107);晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______ pm.(只列出计算式即可)
(1)砷元素基态原子的电子排布式为
(2)砷与氢元素可形成化合物砷化氢,该化合物的空间构型为
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式
(4)已知由元素砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其中砷原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,通过计算确定铝原子在三维空间中堆积方式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)二氧化钛(TiO2)作光催化剂,能将居室污染物如甲醛(CH2O)、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为____________ ,甲醛的VSEPR模型为______________ ,二氧化碳分子中碳原子的杂化类型为________ 。
(2)写出下列分子或者离子的空间构型:PO43-______________ ; ClO3- ________________ 。
(3)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出B在周期表中的位置为______________ ,属于_______ 区元素,B基态原子的电子排布式为_________________________________
(1)二氧化钛(TiO2)作光催化剂,能将居室污染物如甲醛(CH2O)、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为
(2)写出下列分子或者离子的空间构型:PO43-
(3)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出B在周期表中的位置为
您最近一年使用:0次




