名校
解题方法
1 . 现有mg含有Na2O杂质的Na2O2样品,某同学在实验室用如下装置(部分夹持仪器已省略)测定其杂质含量:
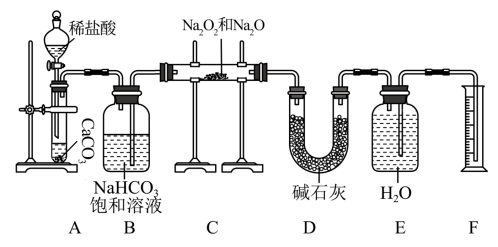
回答下列问题:
(1)装置A中反应的离子方程式为___________ ;该反应基本类型为___________ ,其中CaCO3属于___________ (填“酸”“碱”或“盐”)。
(2)图中有一处明显错误,请指出并改正:___________ 。
(3)装置B的作用是___________ ;装置D的作用是___________ ;若无装置D,样品中杂质的质量分数___________ (填“偏高”“偏低”或“无影响”)。
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:___________ 。
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为___________ (用含m、V的代数式表示,列出计算式即可)。

回答下列问题:
(1)装置A中反应的离子方程式为
(2)图中有一处明显错误,请指出并改正:
(3)装置B的作用是
(4)写出装置C中Na2O2与CO2发生反应的化学方程式:
(5)实验结束后,装置F中水的体积为V mL,已知氧气的密度为1.43 g· L-1,样品中杂质的质量分数为
您最近一年使用:0次
2022-01-18更新
|
110次组卷
|
2卷引用:内蒙古乌兰浩特第一中学2022-2023学年高一上学期期中考试化学试题
2 . 蛋白质在一定条件下反应可将其中的氮元素转化为氨气(NH3)析出。现用上述方法测量某品牌牛奶中蛋白质的含量。具体操作如下:
①配制1.00mol•L-1H2SO4溶液和2.00mol•L-1NaOH溶液
②取30.0g牛奶样品,将所含蛋白质中的氮元素全部转化为氨气
③用2.00mol•L-1的NaOH溶液中和过量的稀硫酸,记录所消耗NaOH溶液的体积
④用25.00mL1.00mol•L-1H2SO4溶液将氨(NH3)完全吸收(NH3+H+=NH )
)
(1)正确的操作顺序是__ (填序号)。
(2)测量过程中步骤③中发生的离子方程式为__ 。
(3)该测定实验共进行了4次.实验室现有50mL,100mL,250mL,500mL4种规格的容量瓶,则配制H2SO4溶液应选用的容量瓶的规格为:__ 。
(4)配制2.00mol•L-1100mL的NaOH溶液(用固体烧碱配制),有以下仪器和用品有:a.烧杯、b.滤纸、c.500mL容量瓶、d药匙、e.胶头滴管、f.托盘天平(带砝码)。
①配制时,不需要使用的仪器和用品有__ (填序号),还缺少的仪器是__ 。
②容量瓶在使用前必须检查__ 。
③下列实验操作会使溶液浓度偏小的是__ 。
a.称量时烧碱固体已潮解
b.容量瓶中有少量蒸馏水
c.在容量瓶中进行定容时俯视刻度线
d.烧杯中溶液未冷却就转移到容量瓶
e.转移溶液后未洗涤烧杯和玻璃棒就直接定容
(5)某同学4次测定所消耗的NaOH溶液的体积如下:
若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为__ 。
①配制1.00mol•L-1H2SO4溶液和2.00mol•L-1NaOH溶液
②取30.0g牛奶样品,将所含蛋白质中的氮元素全部转化为氨气
③用2.00mol•L-1的NaOH溶液中和过量的稀硫酸,记录所消耗NaOH溶液的体积
④用25.00mL1.00mol•L-1H2SO4溶液将氨(NH3)完全吸收(NH3+H+=NH
 )
)(1)正确的操作顺序是
(2)测量过程中步骤③中发生的离子方程式为
(3)该测定实验共进行了4次.实验室现有50mL,100mL,250mL,500mL4种规格的容量瓶,则配制H2SO4溶液应选用的容量瓶的规格为:
(4)配制2.00mol•L-1100mL的NaOH溶液(用固体烧碱配制),有以下仪器和用品有:a.烧杯、b.滤纸、c.500mL容量瓶、d药匙、e.胶头滴管、f.托盘天平(带砝码)。
①配制时,不需要使用的仪器和用品有
②容量瓶在使用前必须检查
③下列实验操作会使溶液浓度偏小的是
a.称量时烧碱固体已潮解
b.容量瓶中有少量蒸馏水
c.在容量瓶中进行定容时俯视刻度线
d.烧杯中溶液未冷却就转移到容量瓶
e.转移溶液后未洗涤烧杯和玻璃棒就直接定容
(5)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V/mL | 19.00 | 19.10 | 19.00 | 18.90 |
若蛋白质中氮元素的质量分数为14.0%,则样品中蛋白质的质量分数为
您最近一年使用:0次
2021-12-11更新
|
103次组卷
|
2卷引用:内蒙古自治区赤峰市红山区2021-2022学年高一上学期期末考试化学试题
名校
解题方法
3 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为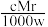 | B.物质的量浓度c可表示为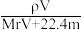 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为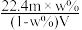 |
您最近一年使用:0次
2023-10-29更新
|
1132次组卷
|
42卷引用:内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题
内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
4 . 实验室有浓盐酸的质量分数为36.5%,密度为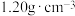
(1)需要配制 的盐酸,配制时需用量筒量取以上浓盐酸的体积为
的盐酸,配制时需用量筒量取以上浓盐酸的体积为_____ mL;
(2)上述实验中所用到的实验仪器烧杯、玻璃棒、胶头滴管、_____
(3)用浓盐酸配制 稀盐酸,操作步骤的正确顺序是
稀盐酸,操作步骤的正确顺序是_____ (填序号)
a、计算需要浓盐酸的体积
b、用量筒量取浓盐酸:
c、将烧杯中的溶液转移入容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也转移入容量瓶中;
d、把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却;
e、盖好瓶塞,反复上下颠倒,摇匀;
f、继续向容量瓶中加蒸馏水至距离刻度线1-2cm处,改用胶头滴管,小心滴加蒸馏水至凹液面最低点与刻度线相切。
(4)在配制过程中,玻璃棒所起的作用_____
(5)容量瓶使用前,需进行的实验操作为_____
(6)上述操作d中,溶液注入容量瓶前需恢复至室温,原因为_____
(7)下列操作使溶液物质的量浓度偏高的是:_____ 。
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量溶液溅出
D.未冷却至室温就转移定容
E.定容时俯视刻度线
F.量取盐酸时仰视
G.洗涤量取浓溶液的量筒,并将洗涤液转移到容量瓶中
H.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线
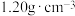
(1)需要配制
 的盐酸,配制时需用量筒量取以上浓盐酸的体积为
的盐酸,配制时需用量筒量取以上浓盐酸的体积为(2)上述实验中所用到的实验仪器烧杯、玻璃棒、胶头滴管、
(3)用浓盐酸配制
 稀盐酸,操作步骤的正确顺序是
稀盐酸,操作步骤的正确顺序是a、计算需要浓盐酸的体积
b、用量筒量取浓盐酸:
c、将烧杯中的溶液转移入容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也转移入容量瓶中;
d、把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却;
e、盖好瓶塞,反复上下颠倒,摇匀;
f、继续向容量瓶中加蒸馏水至距离刻度线1-2cm处,改用胶头滴管,小心滴加蒸馏水至凹液面最低点与刻度线相切。
(4)在配制过程中,玻璃棒所起的作用
(5)容量瓶使用前,需进行的实验操作为
(6)上述操作d中,溶液注入容量瓶前需恢复至室温,原因为
(7)下列操作使溶液物质的量浓度偏高的是:
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量溶液溅出
D.未冷却至室温就转移定容
E.定容时俯视刻度线
F.量取盐酸时仰视
G.洗涤量取浓溶液的量筒,并将洗涤液转移到容量瓶中
H.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线
您最近一年使用:0次
5 . 氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。
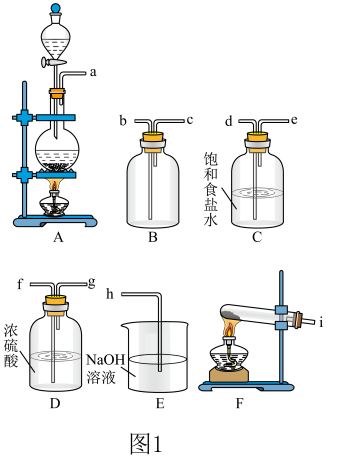
(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:___________ ;已知浓盐酸的质量分数为36.5%,密度为1.15 g/mL,则该浓盐酸的物质的量浓度是___________ ;浓盐酸起酸性作用和还原剂作用的物质的量之比为___________ 。
②选择装置,将各仪器按先后顺序连接起来,应该是a→___________ →h(用导管口处的字母表示)。
(2)装置C中饱和食盐水的作的作用是___________
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:___________ ,实验结束后检验E中溶液含有氯离子的实验操作是___________
(4)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。
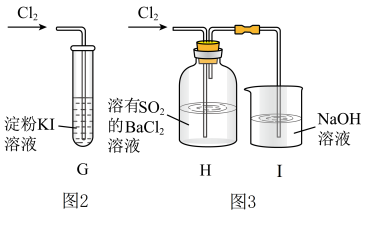
①G中的现象是___________ ,原因是___________ (用化学方程式表示)。
②H中溶液变浑浊,原因是___________ ,___________ (用离子方程式表示)。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:
②选择装置,将各仪器按先后顺序连接起来,应该是a→
(2)装置C中饱和食盐水的作的作用是
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:
(4)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是
②H中溶液变浑浊,原因是
您最近一年使用:0次
名校
6 . Ⅰ.某同学欲用密度为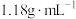 、质量分数为36.5%的浓盐酸配制220mL
、质量分数为36.5%的浓盐酸配制220mL 稀盐酸,请你帮助他完成这一任务。
稀盐酸,请你帮助他完成这一任务。

(1)应量取的浓盐酸体积______ mL,应选用的容量瓶的规格______ mL。
(2)在配制溶液的过程中,如图所示仪器还需增加的玻璃仪器除了烧杯还有______ (填仪器名称)。
(3)在配制稀盐酸溶液时:
①其正确的操作顺序是______ (用字母符号表示,每个符号只能用一次)。
A.用30mL蒸馏水洗涤玻璃仪器各2~3次,洗涤液全部注入容量瓶并轻摇容量瓶
B.用量筒准确量取所需体积的浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
C.将已恢复至室温的盐酸移液操作注入所选用的容量瓶中
D.盖好瓶塞,反复上下颠倒摇匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
②下列操作可能使所配溶液浓度偏高的是______ (填字母)。
A.没有进行操作A
B.没有进行操作C
C.定容俯视容量瓶瓶颈上的刻度线
D.加蒸馏水不慎超过容量瓶瓶颈上的刻度线
E.容量瓶用蒸馏水洗净后,没烘干直接使用
③若实验中出现以下情况,应该怎么处理:向容量瓶中转移溶液时(操作C)不慎将少量溶液洒到容量瓶外面:______ 。
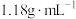 、质量分数为36.5%的浓盐酸配制220mL
、质量分数为36.5%的浓盐酸配制220mL 稀盐酸,请你帮助他完成这一任务。
稀盐酸,请你帮助他完成这一任务。
(1)应量取的浓盐酸体积
(2)在配制溶液的过程中,如图所示仪器还需增加的玻璃仪器除了烧杯还有
(3)在配制稀盐酸溶液时:
①其正确的操作顺序是
A.用30mL蒸馏水洗涤玻璃仪器各2~3次,洗涤液全部注入容量瓶并轻摇容量瓶
B.用量筒准确量取所需体积的浓盐酸注入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其混合均匀
C.将已恢复至室温的盐酸移液操作注入所选用的容量瓶中
D.盖好瓶塞,反复上下颠倒摇匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
F.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线1~2cm处
②下列操作可能使所配溶液浓度偏高的是
A.没有进行操作A
B.没有进行操作C
C.定容俯视容量瓶瓶颈上的刻度线
D.加蒸馏水不慎超过容量瓶瓶颈上的刻度线
E.容量瓶用蒸馏水洗净后,没烘干直接使用
③若实验中出现以下情况,应该怎么处理:向容量瓶中转移溶液时(操作C)不慎将少量溶液洒到容量瓶外面:
您最近一年使用:0次
名校
解题方法
7 . 钠的化合物在日常生活中的应用非常广泛,回答下列问题:
Ⅰ.为了测定 和NaHCO3的混合物中
和NaHCO3的混合物中 的质量分数,某同学用如下装置完成实验。
的质量分数,某同学用如下装置完成实验。
(1)实验前首先要进行的操作是_______ 。
(2)某同学称取65.4g混合物于锥形瓶中,打开止水夹,通入 ,一段时间后,关闭止水夹,称量装置C,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间
,一段时间后,关闭止水夹,称量装置C,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间 。停止通
。停止通 ,装置C的质量增加30.8g。
,装置C的质量增加30.8g。

①两次通入 的目的分别是
的目的分别是_______ 、_______ 。
②混合物中 的质量为
的质量为_______ g。
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。

资料:沉淀池中的反应为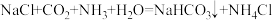 。
。
(3)操作1的名称为_______ ;煅烧炉中反应的化学方程式为_______ 。
(4)物质X可循环利用,其化学式为_______ 。
(5)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与 反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是_______ 。
Ⅰ.为了测定
 和NaHCO3的混合物中
和NaHCO3的混合物中 的质量分数,某同学用如下装置完成实验。
的质量分数,某同学用如下装置完成实验。(1)实验前首先要进行的操作是
(2)某同学称取65.4g混合物于锥形瓶中,打开止水夹,通入
 ,一段时间后,关闭止水夹,称量装置C,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间
,一段时间后,关闭止水夹,称量装置C,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间 。停止通
。停止通 ,装置C的质量增加30.8g。
,装置C的质量增加30.8g。
①两次通入
 的目的分别是
的目的分别是②混合物中
 的质量为
的质量为Ⅱ.侯德榜“联合制碱法”将制碱技术发展到个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。

资料:沉淀池中的反应为
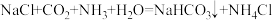 。
。(3)操作1的名称为
(4)物质X可循环利用,其化学式为
(5)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与
 反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是
您最近一年使用:0次
2022-11-04更新
|
151次组卷
|
2卷引用:内蒙古乌兰浩特市第四中学2022-2023学年高一上学期第三次月考化学试题
解题方法
8 . 将50 g质量分数为w1、物质的量浓度为c1的浓硫酸加入V mL水(水的密度为1 g/cm3)中,稀释后得到质量分数为w2、物质的量浓度为c2的稀硫酸。下列说法中正确的是
| A.若w1=2w2,则V>50 | B.若w1=2w2,则V<50 |
| C.若c1=2c2,则V>50 | D.若c1=2c2,则V<50 |
您最近一年使用:0次
名校
9 . 设 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.12.4g白磷(P4)中所包含的 共价键有 共价键有 |
B. 的 的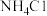 溶液中通入适量氨气后呈中性,此溶液中 溶液中通入适量氨气后呈中性,此溶液中 数目为 数目为 |
C.向含有 的溶液中通入适量氯气,当有 的溶液中通入适量氯气,当有 被氧化时,该反应转移电子数目为 被氧化时,该反应转移电子数目为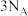 |
D.10g环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,其中所含的氧原子数目为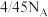 |
您最近一年使用:0次
2022-10-29更新
|
307次组卷
|
3卷引用:内蒙古赤峰二中2023届高三上学期10月第二次月考化学试题
内蒙古赤峰二中2023届高三上学期10月第二次月考化学试题内蒙古赤峰二中2022-2023学年高三上学期第二次月考化学试题 (已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)
名校
解题方法
10 . 实验室需要480 mL 1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题。
(1)实验中除了托盘天平、药匙、量筒、烧杯、玻璃棒外还需要的仪器有_______ 。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中错误的是_______ (填序号)。
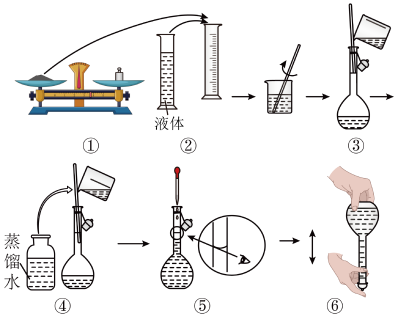
(3)称取NaOH固体时,所需砝码的质量为_______(填字母)。
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的步骤是_______ (填代号)。
①称量 ②溶解 ③转移 ④洗涤 ⑤定容
(5)下列操作会导致所配溶液的物质的量浓度偏大的是_______ 。
A.NaOH固体长期露置在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量NaOH固体时,将物质和砝码位置放反
D.定容时液面高于刻度线,用胶头滴管将多出的部分液体吸出
E.定容时俯视刻度线
(6)若用质量分数为98%、密度为1.84g/mL的浓硫酸来配制0.4mol/L硫酸溶液475mL,需用量筒量取体积为_______ mL的浓硫酸来稀释。
(1)实验中除了托盘天平、药匙、量筒、烧杯、玻璃棒外还需要的仪器有
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中错误的是

(3)称取NaOH固体时,所需砝码的质量为_______(填字母)。
| A.19.2 g | B.20 g |
| C.19.2~20 g | D.大于20 g |
①称量 ②溶解 ③转移 ④洗涤 ⑤定容
(5)下列操作会导致所配溶液的物质的量浓度偏大的是
A.NaOH固体长期露置在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量NaOH固体时,将物质和砝码位置放反
D.定容时液面高于刻度线,用胶头滴管将多出的部分液体吸出
E.定容时俯视刻度线
(6)若用质量分数为98%、密度为1.84g/mL的浓硫酸来配制0.4mol/L硫酸溶液475mL,需用量筒量取体积为
您最近一年使用:0次



