解题方法
1 . 在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是___________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是_______________________________________________ 。
乙同学认为是O2,其可能的理由是______________________________________________ 。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_________________ 。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为________________________________________ 。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为________ mol·L-1;铁钉中单质铁的质量分数为____________ 。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是
乙同学认为是O2,其可能的理由是
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 两投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
所配硫酸的物质的量浓度为
您最近一年使用:0次
2020-09-22更新
|
104次组卷
|
2卷引用:内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题
名校
解题方法
2 . I.碳、硫的含量对钢铁性能影响很大,其含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。实验流程如图:
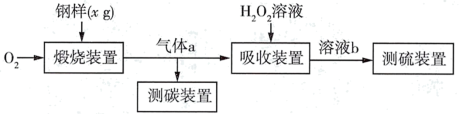
(1)煅烧装置中采用纯氧,目的是_______ 。气体a的主要成分有_____ 、CO2和未反应的O2。
(2)为充分吸收气体a,下列吸收装置中合适的是______ (填标号)。
A.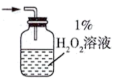 B.
B.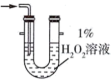
C.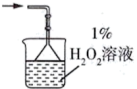 D.
D.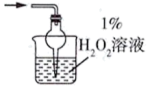
(3)气体a被 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。
①滴定时 溶液置于
溶液置于_____ (填仪器名称)中,若以酚酞为指示剂,终点时的现象为_______ 。
②若称取1 g钢样进行实验,滴定消耗 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为_____ 。
(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。
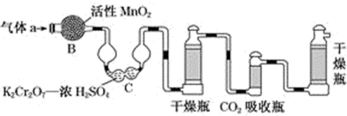
①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是______ 。
②计算钢样中碳的质量分数,应测量的数据是_______ 。
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是______ (填标号)
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为________ 。
(2)电弧炉中生成粗硅,反应的化学方程式为_______ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为___________ 。

(1)煅烧装置中采用纯氧,目的是
(2)为充分吸收气体a,下列吸收装置中合适的是
A.
 B.
B.
C.
 D.
D.
(3)气体a被
 溶液吸收转化为硫酸(溶液b),用已知浓度的
溶液吸收转化为硫酸(溶液b),用已知浓度的 溶液滴定生成的溶液b,根据消耗
溶液滴定生成的溶液b,根据消耗 溶液的体积可确定钢样中硫的质量分数。
溶液的体积可确定钢样中硫的质量分数。①滴定时
 溶液置于
溶液置于②若称取1 g钢样进行实验,滴定消耗
 溶液
溶液 ,则该钢样中硫的质量分数为
,则该钢样中硫的质量分数为(4)若将气体a通入以下测碳装置中(如图),采用重量法测定碳的含量。

①气体a通过B和C的目的是除去SO2,通过所用试剂判断该法所利用的SO2的性质是
②计算钢样中碳的质量分数,应测量的数据是
II.回答下列问题:
(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是
A.Al B.Al2O3C.CuO D.NaHCO3
SiO2还能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为
(2)电弧炉中生成粗硅,反应的化学方程式为
您最近一年使用:0次
3 . 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
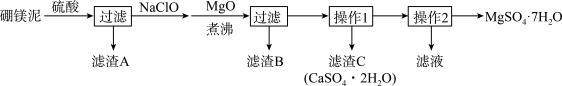
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___ 。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___ 。
(3)加入MgO后,加热煮沸的目的是___ 。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___ 。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___ 。
(6)获取MgSO4·7H2O的操作2为:___ 、___ 、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___ (能或不能),表达式(或理由)为___ 。

已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
| 温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(2)滤渣A中除含少量CaSO4·2H2O外,还有
(3)加入MgO后,加热煮沸的目的是
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止
(6)获取MgSO4·7H2O的操作2为:
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。
您最近一年使用:0次
2020-04-04更新
|
355次组卷
|
3卷引用:内蒙古呼伦贝尔市海拉尔区2020届高三上学期第一次模拟统一考试理科综合化学试题
名校
4 . 下列关于碱金属及其化合物的叙述错误的是
| A.金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B.干粉灭火器能用于扑灭金属钠、钾的着火 |
| C.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D.Na-K合金用作快中子反应堆的导热剂 |
您最近一年使用:0次
5 . 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________ ;
(2)该注射液中葡萄糖的物质的量浓度为__________ 。(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________ 。

(1)该注射液中葡萄糖的质量分数为
(2)该注射液中葡萄糖的物质的量浓度为
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是
您最近一年使用:0次
6 . 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为________________ mol.L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______________(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol.L-1的稀盐酸。
①该学生需要量取_______________ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面________
b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水________
(4)①假设该同学成功配制了0.400mol.L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取_______________ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_______________ 。(填字母)
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g.cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______________(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的物质的量浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol.L-1的稀盐酸。
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol.L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-01-07更新
|
20次组卷
|
2卷引用:内蒙古自治区赤峰四中2021-2022学年高一上学期第一次月考化学试题
名校
解题方法
7 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为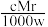 | B.物质的量浓度c可表示为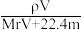 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为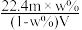 |
您最近一年使用:0次
2023-10-29更新
|
1131次组卷
|
42卷引用:2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷
2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
10-11高三上·江苏泰州·阶段练习
名校
解题方法
8 . 向一定量的Fe、FeO、Fe2O3的混合物中加入100mL1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况下)的气体。所得溶液中加入KSCN溶液无红色出现,混合物中铁元素的质量分数为
| A.81.4% | B.77.8% | C.68.6% | D.无法计算 |
您最近一年使用:0次
2023-01-06更新
|
893次组卷
|
11卷引用:2010年江苏省泰兴市重点中学高三上学期第一次检测化学试题
(已下线)2010年江苏省泰兴市重点中学高三上学期第一次检测化学试题2016届湖南省益阳市箴言中学高三上学期第三次模拟化学试卷2016-2017学年湖北省武钢三中高一12月月考化学试卷2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷江苏省启东中学2017-2018学年高一(创新2班)上学期期中考试化学试题 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)天津市耀华中学2022-2023学年高一上学期期末考试化学试题天津市耀华中学2022-2023学年高一上学期期末考试化学试题 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题
名校
9 . 把5.1g镁铝合金的粉末放入过量的稀盐酸中,得到5.6L氢气(标准状况下)。试计算:
(1)该合金中铝的质量分数(保留一位小数)______
(2)该合金中镁和铝的物质的量之比为______
(1)该合金中铝的质量分数(保留一位小数)
(2)该合金中镁和铝的物质的量之比为
您最近一年使用:0次
2021-11-05更新
|
1051次组卷
|
10卷引用:云南民族大学附属中学2017-2018学年高一下学期期中考试化学试题
云南民族大学附属中学2017-2018学年高一下学期期中考试化学试题内蒙古赤峰学院附属中学2020-2021学年高一上学期期末考试化学试题甘肃省兰州市第四片区2020-2021学年高一上学期期末考试化学试题福建省建瓯市芝华中学2020-2021学年高一下学期第一阶段考试化学试题上海实验高中2021-2022学年高一上学期第一次测试化学试题人教2019版必修第一册第三章 铁 金属材料复习与提高苏教2020版化学必修第二册专题9第三单元 金属材料的性能及应用课后习题广西钦州市第四中学2022-2023学年高一上学期11月份考试化学试题上海市实验学校2021-2022学年高一上学期第一次测试化学试题甘肃省兰州新华互联网学校2023-2024学年高一上学期期末考题化学试卷
11-12高一·广东梅州·期末
名校
10 . 把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
| A.70% | B.52.4% | C.47.6% | D.30% |
您最近一年使用:0次
2021-09-30更新
|
322次组卷
|
30卷引用:14-15内蒙古北方重工业集团三中高一上学期期末化学试卷
14-15内蒙古北方重工业集团三中高一上学期期末化学试卷2015-2016学年内蒙古集宁一中高一上第二次月考化学试卷(已下线)2011-2012学年广东梅州市曾宪梓中学高一年级期末考试化学试卷(已下线)2012年鲁科版高中化学必修1 4.2铝 金属材料练习卷(已下线)2012年苏教版高中化学必修1 3.2铁、铜的获取及应用练习卷2014-2015学年天津市宝坻区四校高一11月联考化学试卷2015-2016学年吉林省长春市第二中学高一上学期第三次月考化学试卷2015-2016学年山西省大同一中高一上期末考试化学试卷2015-2016学年安徽省合肥三中高一上学期12月月考化学试卷2015-2016学年甘肃省嘉峪关市酒钢三中高一上学期期末化学试卷2015-2016学年湖南省长沙市望城一中高二下期末理科化学试卷2016-2017学年山西省太原五中高二上10月月考化学试卷黑龙江省哈尔滨市第六中学2016-2017学年高二下学期期末考试化学试题河北省故城县高级中学2018届高三9月月考化学试题江苏省盐城市时杨中学2017-2018学年高二上学期期中考试(必修)化学试题江西省南昌市第十中学2017-2018学年高一上学期期末考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期第二次月考化学试题【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题【全国百强校】湖南省长沙市长郡中学2018-2019学年高一下学期开学考试化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题四川省成都外国语学校2019-2020学年高一12月月考化学试题四川省成都外国语学校2019-2020学年高一上期第二次月考化学试题云南省昭通市大关县第一中学2019-2020学年高一上学期期末考试化学试题河南省郑州市第一中学2021届高三上学期开学测试化学试题浙江省东阳中学2020-2021学年高二上学期期中考试化学试题宁夏贺兰县景博中学2020-2021学年高一上学期第二次月考化学试题贵州省贵阳市清镇养正学校2020-2021学年高一上学期第三次月考化学试题浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题新疆喀什第二中学2021-2022学年高一11月月考化学试题



