名校
解题方法
1 . A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置 如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
(1)BF2的结构式为____________ 。
(2)D和 F氢化物中沸点较高的___________________ 填化学式)。
(3)工业制取E单质的化学方程式为______________ 。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________ 。
(5)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入 太空,并且产生三种无污染的气体,其化学方程式为____________ 。
| B | ||
| F |
(1)BF2的结构式为
(2)D和 F氢化物中沸点较高的
(3)工业制取E单质的化学方程式为
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
(5)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入 太空,并且产生三种无污染的气体,其化学方程式为
您最近一年使用:0次
名校
解题方法
2 . Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂,某课外小组测定该补血剂中铁元素的含量.实验步骤如下::
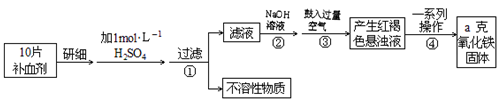
请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为______________ 。步骤③中反应的化学方程式为_____________________ 。
(2)步骤④中一系列处理的操作步骤:___________ 、洗涤、___________ 、冷却、称量.
(3)实验中需用98%浓硫酸(密度1.84g/mL)配制1mol/L的稀硫酸480mL,配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有___________ ,需用量筒量取浓硫酸________ mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量___________ g(用含a的代数式表示)

请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为
(2)步骤④中一系列处理的操作步骤:
(3)实验中需用98%浓硫酸(密度1.84g/mL)配制1mol/L的稀硫酸480mL,配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有
(4)若实验无损耗,则每片补血剂含铁元素的质量
您最近一年使用:0次
2017-02-17更新
|
1426次组卷
|
5卷引用:内蒙古赤峰二中2021-2022学年高一上学期期末考试化学试题
3 . 国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是________ (选填序号).
(2)检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是________ ,铝元素发生变化的离子方程式是______________________ .
(3)为了回收废液中的金属银,某同学设计了如下方案:

若依该方案获得银108 g,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气________ L.
(1)该废液中可能大量存在的一种阴离子是
A.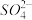 | B.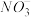 | C.Cl- | D. |
(2)检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是
(3)为了回收废液中的金属银,某同学设计了如下方案:

若依该方案获得银108 g,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气
您最近一年使用:0次
2016-12-08更新
|
100次组卷
|
2卷引用:14-15内蒙古北方重工业集团三中高二上学期考试化学文科试卷
4 . 氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种地壳中含量最多的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲的化学式是____________ 。
(2)甲与水反应的化学方程式是_______________________ 。
(3)气体丙与金属镁反应的产物是________ (用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式______________ 。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之___________ 。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)甲的化学式是
(2)甲与水反应的化学方程式是
(3)气体丙与金属镁反应的产物是
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之
您最近一年使用:0次
2016-12-09更新
|
386次组卷
|
2卷引用:2014-2015内蒙古北方重工业集团三中高一下学期第一次月考化学试卷
2014·江苏扬州·一模
解题方法
5 . 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是_____ (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是_______ 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是__ ;反应Ⅲ的化学方程式为________________ 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是_________________________ 。
② 滴定过程中,至少须平行测定两次的原因是________________________ 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为__________ mol·L-1(用含字母的代数式表示)。

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是
② 滴定过程中,至少须平行测定两次的原因是
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为
您最近一年使用:0次
2016-12-09更新
|
1483次组卷
|
5卷引用:2017届内蒙古赤峰市宁城县高三上统一考试化学试卷
2017届内蒙古赤峰市宁城县高三上统一考试化学试卷(已下线)2014届江苏省扬州中学高三年级模拟考试化学试卷(已下线)2014届江苏省高三百校联合调研测试(一)化学试卷(已下线)2014届江苏启东中学第二学期期中考试高二实验班化学试卷陕西省汉中市龙岗学校2019-2020学年高二上学期期末考试化学试题
14-15高三上·甘肃兰州·期中
名校
解题方法
6 . 硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示
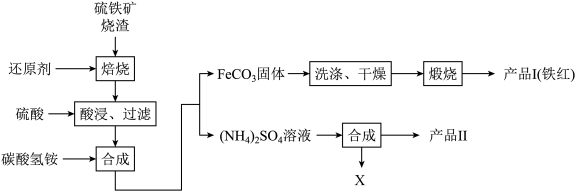
回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为___________ 。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为___________ 。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是___________ 。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为___________ ,反应的离子方程式为___________ 。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为___________ 。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,___________ 。

回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
您最近一年使用:0次
2016-12-09更新
|
231次组卷
|
3卷引用:内蒙古阿拉善左旗高级中学 2018届高三10月月考理综化学试题



